Биохимическая диагностика деструкции миокарда Предсердный натрийуретический пептид (анп, anp)
 Скачать 158.85 Kb. Скачать 158.85 Kb.
|
|
Биохимическая диагностика деструкции миокарда Предсердный натрийуретический пептид (АНП, ANP) - показатель повышения напряжения миокарда при увеличении давления в левом желудочке сердца. Основные показания к применению: диагностика и прогностические цели в оценки развития сердечной недостаточности.Натрий-уретические пептиды участвуютв регуляции объёма натрия и воды.Первым был открыт атриальный натрийуретический пептид (АНП), или атриальныйнатрийуретический пептидтипа А. АНП — пептид, состоящий из 28 аминокислотных остатков, синтезируется и хранится в виде прогормона (126 аминокислотных остатков) в кардиомиоцитах правого и левого предсердия (в гораздо меньшей степени в желудочках сердца), секретируется в виде неактивного димера, который превращается в активный мономер в плазме крови. Главные факторы, регулирующие секрецию АНП, — увеличенный объём циркулирующей крови и повышенное центральное венозное давление. Среди других регуляторных факторов необходимо отметить высокое артериальное давление, повышенную осмолярность плазмы, учащение сердечных сокращений и повышенную концентрацию катехоламинов в крови. Первичная мишень для АНП — почки, но он действует также на периферические артерии. В почках АНП повышает давление в клубочке, то есть увеличивает фильтрационное давление. АНП способен усиливать фильтрацию, даже если внутриклубочковое давление не изменяется. Это приводит к увеличению экскреции натрия (натрийурез) вместе с первичной мочой. В настоящее время описан целый ряд структурно подобных, но генетически различных гормонов семейства натрийуретических пептидов, которые участвуют в поддержании гомеостаза натрия и воды. К ним относятся:атриальный натрийуретического пептида типа А, мозговой натрийуретический пептид типа В и натрийуретический пептид типа C (состоит из 22 аминокислот). Мозговой натрийуретический пептид типа Всинтезируется в миокарде правого желудочка в виде прогормона — промозгового натрийуретического пептида, а тип C в ткани мозга и сосудистом эндотелии. Каждый из этих пептидов является продуктом экспрессии отдельного гена.  Рис. Эффекты атриального натрийуретического пептида В плазме крови АНП находится в виде нескольких форм прогормона. Существующие диагностические системы основаны на способности определять концентрацию С-концевого пептида про-АНП с 99-126 аминокислотными остатками (а-АНП) или двух форм с N-концевым пептидом — про-АНП с 31-67 аминокислотными остатками, и про-АНП с 78-98 аминокислотными остатками.Содержание предсердного натрийуретического пептида в норме составляет 20-77 пг/мл.Референтные величины концентраций в плазме крови составляют для а-АНП — 8,5+1,1 пмоль/л (период полужизни 3 мин), N-про-АНП с 31-67 аминокислотными остатками — 143,0+16,0 пмоль/л (период полужизни 1-2 ч), N-про-АНП с 78-98 аминокислотными остатками — 587+83 пмоль/л. Считается, что про-АНП с N-концевым пептидом более устойчив в крови, поэтому его исследование предпочтительно для клинических целей. В последние годы АНП и мозговой натрийуретический пептид типа В рассматривают как потенциальные маркёры оценки функционального состояния сократительной способности сердечной мышцы (маркёр выраженности сердечной недостаточности) и самые важные прогностические показатели исхода заболеванийсердца. Концентрация АНП в плазме крови повышена у пациентов с застойной сердечной недостаточностью, отёками, острой и хронической почечной недостаточностью, при циррозе печени с асцитом. У больных в подострой фазе инфаркта миокарда концентрация натрийуретических пептидов в плазме крови служит лучшим маркёром для диагностики сердечной недостаточности и обладает прогностической значимостью в плане исхода заболевания и смерти. Наличие сердечной недостаточности может быть исключено в 98% случаев при концентрации АНП ниже 18,1 пмоль/л (62,6 пг/мл) и мозгового натрийуретического пептида типа В — ниже 22,2 пмоль/л (76,8 пг/мл).В качестве точки разделения в отношении диагностики сердечной недостаточности для N-концевого промозгового натрийуретического пептида используют значения выше 80 пмоль/л. Тропонины представляют собой белковые молекулы, формирующие состоящий из трех субъединиц (Тп С, Тп Т и Тп I) комплекс, расположенный на актиновыхфиламентахмиокарда. Тропониновый комплекс участвует в процессах сокращения и расслабления миокарда. Тп С — Са2+-связанный протеин — участвует в регуляции деятельности актиновыхфиламентов. Тп I ингибирует процесс сокращения мышечных волокон при нарушении связи Тп Сс ионами кальция. Тп Т обеспечивает взаимодействие всего тропонинового комплекса с тропомиозином и филаментами актина. В то время как основная часть сердечных тропонинов фиксирована на сократительных белках, небольшое их количество (6—8% Тп Т и 3,5% Тп I) находится в свободном состоянии в цитозоле (рисунок). Продемонстрировано, что Тп Т и Тп I — более специфичные и чувствительные маркеры миокардиального повреждения, чем креатинфосфокиназа и ее МВ фракция.Концентрация сердечных тропонинов в крови повышается уже через 3-4 часа после случившегося приступа и остаётся в кровяном русле до двух недель. 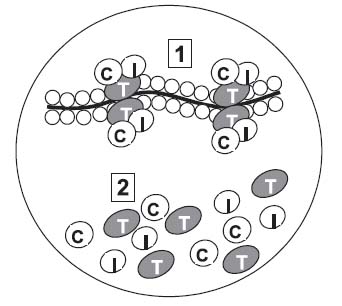 Рисунок. Внутриклеточные фракции тропонинов: 1 – связанная фракция тропонинов; 2 – цитозольная фракция тропонинов Креатинкиназа (креатинфосфокиназа, КФК) — это фермент, катализирующий образование из АТФ и креатина высокоэнергетического соединения -креатинфосфата, который расходуется организмом при увеличенных физических нагрузках. КФК содержится в клетках сердечной мышцы, скелетной мускулатуры, головного мозга, щитовидной железы, легких. Наибольшее клиническое значение имеют следующие изоферменты (фракции) креатинкиназы: КФК-МВ (сердечный изофермент, изменяющийся при повреждении клеток миокарда), КФК-ВВ (мозговой изофермент, отражающий патологию клеток головного мозга), КФК-ММ (мышечный изофермент, находящийся в скелетных мышцах).В норме в плазме крови они имеют соотношение:
Повышение активности общей креатинфосфокиназы наблюдается при повреждении любых вышеперечисленных клеток и поэтому не является специфичным. Наиболее часто значительное увеличение активности данного фермента отмечается при остром инфаркте миокарда.Определение креатинфосфокиназы, и особенно МВ-фракции, широко используется для ранней диагностики инфаркта миокарда, так как ее повышение отмечается уже через 2-4 часа после острого болевого приступа; возврат показателя к норме происходит достаточно быстро (на 3-6 сутки), поэтому определение общей креатинфосфокиназы в крови в более поздние сроки для диагностики инфаркта миокарда малоинформативно. Повышение активности креатинфосфокиназы нередко наблюдается и при острых миокардитах, однако является не столь выраженным и держится значительно дольше, чем при инфаркте.Высокая активность общей креатинфосфокиназы нередко встречается при травматических повреждениях и заболеваниях скелетных мышц (например, при прогрессирующей мышечной дистрофии, миопатии, дерматомиозите).  Миоглобин - железосодержащий белок мышечных клеток, содержащийся в клетках скелетных мышц и в миокарде, обеспечивающий в них депонирование кислорода. Молекула миоглобина образована единичной полипептидной цепью и железосодержащим гемом и сходна по строению и функциям с гемоглобином крови. Миоглобин связывает кислород (образуется оксимиоглобин) и является основным его поставщиком для скелетных мышц. Выводится миоглобин в неизмененном виде с мочой, поэтому его концентрация также зависит от функции почек. При любом повреждении, некрозе, лизисе ткани скелетной мускулатуры или миокарда миоглобин поступает в кровь. При инфаркте миокарда выраженность гипермиоглобинемии находится в прямой зависимости от размеров очага некроза. Это один из самых ранних маркеров инфаркта миокарда (обнаруживается уже через 2 часа после приступа, увеличение концентрации может быть 10-кратным). Определение концентрации миоглобина обычно назначается вместе с другими маркерами повреждения сердечной мышцы, такими как креатинфосфокиназа-МВ и тропонин, что позволяет более уверенно судить о наличии или, напротив, отсутствии острого повреждения сердечной мышцы. Кроме того, это исследование может понадобиться после массивных повреждений скелетной мускулатуры, чтобы оценить риск повреждения почек и острой почечной недостаточности. Референтные значения концентрации миоглобина в плазме крови
Содержание аспартатаминотрансферазы (АсАТ) в сердце наибольшее из всех внутренних органов.Этот фермент содержится также в мозге, лёгких, скелетных мышцах, почках, печени и в других органах и тканях. Поэтому повышение активности АсАТ в крови — чувствительный, но недостаточно специфичный маркер поражения миокарда. Лактатдегидрогена́за (ЛДГ, лактат, НАД+оксидоредуктаза, дегидрогеназа молочной кислоты)- фермент углеводного обмена, катализирует взаимопревращение пировиноградной и молочной кислот, т. е. реакцию, завершающую внутренний окислительно-восстановительный цикл гликолиза. Активность ЛДГ в сыворотке крови и относительное содержание ее изоферментов при инфаркте миокарда и некоторых других заболеваниях являются информативными диагностическими тестами. Установлено, что в первые двое суток после возникновения инфаркта миокарда активность ЛДГ в сыворотке крови возрастает в 10—15 раз и возвращается к норме лишь на 10—12-й день. Суммарная ЛДГ (имеется 5 изоэнзимов) — поздний маркер инфаркта миокарда, она реагирует позже, чем остальные ферменты. Ее определение обычно производят у больных, поздно поступающих в стационар (через 48—72 ч от начала ИМ). Изофермент ЛДГ1 (его много в сердце) информативнее, ибо его уровень повышается раньше, чем суммарная ЛДГ, а кроме того, может увеличиваться на фоне ее нормальных значений. Ценность определения активности ЛДГ в сыворотке крови особенно велика в случаях инфаркта миокарда с нетипичной клинической и электрокардиографической картиной. Активность ЛДГ в сыворотке крови, измеренная этим методом при 37°, в норме составляет 220—1100 нмоль/(с․л), или 0.8—4,0 мкмоль/(ч․мл). 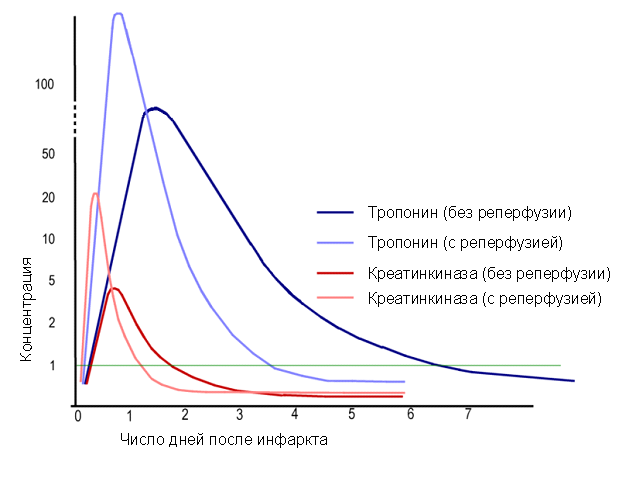 Рис.Тропонин и креатинфосфокиназа в различные сроки течения инфаркта миокарда. Изменения, характерные для инфаркта миокарда Для инфаркта миокарда характерно повышение концентраций специфическихпротеинов. Среди них:
Все перечисленные белки содержатся только внутри миокардиоцита. При массовом разрушении клеток эти белки попадают в кровоток и определяются лабораторно. Это феномен получил название резорбционно-некротического синдрома. Неспецифическая реакция на повреждение миокарда включает в себя:
|
