ОПРЕДЕЛЕНИЕ ЭКВИВАЛЕНТНОЙ МАССЫ МЕТАЛЛА. эквивалент. Цель работы Усвоить одно из основных химических понятий понятие об эквиваленте и научиться определять его количественное значение. Ход работы
 Скачать 28.83 Kb. Скачать 28.83 Kb.
|
|
Цель работы: Усвоить одно из основных химических понятий – понятие об эквиваленте – и научиться определять его количественное значение. Ход работы: 1. Наполнить водой кристаллизатор и бюретку Бунзена (стеклянную трубку с делениями и затвором в виде шарика в резиновой трубке). Проверить надежность затвора. 2. Закрыв верхнее отверстие пальцем, перевернуть бюретку и опустить ее в кристаллизатор с водой. Палец убрать под водой, при этом вода из бюретки не вытечет. 3. Закрепить бюретку в штативе. Уровень воды в ней не должен быть выше крайнего деления шкалы. 4. В колбу Вюрца (круглодонная колба с боковым отводом) при помощи мерного цилиндра отобрать 7 мл соляной кислоты. 5. Вытереть насухо горло колбы фильтром. 6. Расположив колбу горизонтально, поместить в ее горло навеску металла и плотно закрыть колбу пробкой. 7. Поместить присоединенную к боковому отводу колбы Вюрца стеклянную трубку в опущенный в воду конец бюретки. 8. После этого отметить уровень жидкости в бюретке. Показания следует снимать по положению нижнего края вогнутого мениска жидкости при нахождении его на уровне глаз. Цифры на шкале бюретки означают объем в мл, при снятии показаний необходимо учитывать, что бюретка со шкалой перевернута. 9. Затем колбу переводят в вертикальное положение, сбрасывая навеску металла в кислоту. В результате реакции выделяется водород, который вытесняет воду из бюретки. Во время протекания реакции не следует держать колбу в руках во избежание ее нагрева и искажения результатов за счет теплового расширения газа. 10. Когда выделение пузырьков водорода прекратится, отметить конечный уровень воды в бюретке. 11. При помощи линейки измерить высоту столба воды в бюретке от нижнего края мениска до уровня воды в кристаллизаторе. 12. По показаниям барометра и термометра определить атмосферное давление и температуру в лаборатории. Экспериментальные данные: Масса навески металла – mМе=0,0120 г Объем соляной кислоты - VНCl=10 мл Объем воды в бюретке в начале эксперимента – V1=21,4 мл Объем воды в бюретке по окончании эксперимента – V2=8,2 мл Объем выделившегося водорода – Vизм.=V1-V2=13,2 мл Высота столба воды в бюретке h=226 мм Атмосферное давление в лаборатории Pатм= 755 мм рт.ст Температура в лаборатории Т=25оС Обработка экспериментальных данных: 1. Водород находиться в бюретке под давлением ниже атмосферного на величину давления водяного пара, а также разрежения, создаваемого за счет давления столба жидкости в бюретке. Поэтому давление водорода вычисляется по формуле: 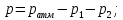 где p1 – давление столба воды в бюретке, Па, p1 = 9,8hρ, где 9,8 – ускорение свободного падения м/с2; ρ – плотность воды, равная 1 г/см3; p2 – давление насыщенного водяного пара, которое находят по табл. 1.1 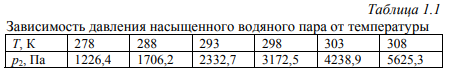 h=226 мм p1=9,8·0,226·1000=2214,8 Па p2=3172,5 Па pатм=755 мм рт. ст.=100658 Па p=100658-2214,8-3172,5=95270,7 Па. 2. Массу выделившегося водорода 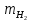 вычисляют по уравнению Клапейрона-Менделеева: вычисляют по уравнению Клапейрона-Менделеева: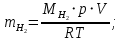 где 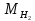 – молярная масса водорода, г/моль; V – объем водорода, м3; R – универсальная газовая постоянная, равная 8,314 Дж/(моль·К), V=13,2 мл=13,2·10-6 м3, Т=25оС=298 К – молярная масса водорода, г/моль; V – объем водорода, м3; R – универсальная газовая постоянная, равная 8,314 Дж/(моль·К), V=13,2 мл=13,2·10-6 м3, Т=25оС=298 К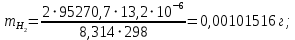 3. Вычислить эквивалент металла по закону эквивалентов: 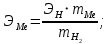 где ЭH – эквивалентная масса водорода, равная 1 г/моль. 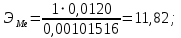 4. Зная степень окисления, найти молярную массу металла и определить, что это за металл: 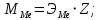 где Z – степень окисления металла, Z=2 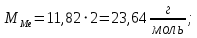 Данный металл – Магний. 5. Вычислить точное значение эквивалентной массы и металла и найти относительную погрешность эксперимента: 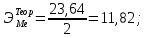 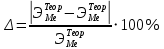 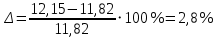 Вывод: В данной лабораторной работе мной определена эквивалентная масса Магния. Погрешность измерений 2,8%, что говорит о том, что опыт проведен верно. |
