Термодинамика. CO(г) H2O(г)
 Скачать 21.02 Kb. Скачать 21.02 Kb.
|
|
Реакция: CO(г) + H2O(г) = CO2(г) + H2(г) T = 250 С = 523 К
Рассчитайте изменение стандартной энтальпии химической реакции. Сделайте вывод о тепловом эффекте химической реакции; Закона Гесса:  Используя справочные данные стандартных энтальпий веществ, находим: 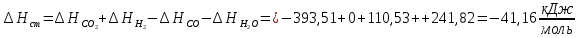 Изменение стандартной энтальпии химической реакции имеет отрицательное значение, следовательно, реакция является экзотермической, т.е. сопровождается выделением теплоты. Ответ:  , реакция экзотермическая. , реакция экзотермическая.Рассчитайте изменение энтальпии химической реакции при температуре ТС, если Ср веществ не зависит от температуры. Так как Ср веществ не зависит от температуры уравнение Кирхгофа выглядит следующим образом: 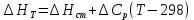 , , где 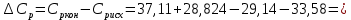 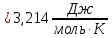 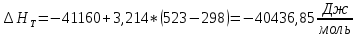 Ответ:  Рассчитайте изменение внутренней энергии реакции при стандартных условиях и при температуре ТС. 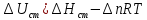 Реакция протекает без изменения количества моль газообразных веществ, следовательно: В стандартных условиях: 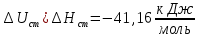 При температуре 250 С:  Ответ: 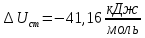 , ,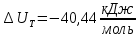 Рассчитайте изменение энтропии реакции при стандартных условиях и при температуре ТС. В стандартных условиях: 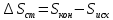 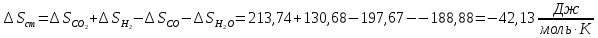 При температуре 250 С: 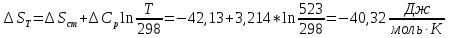 Ответ: 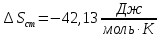 , , 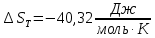 Рассчитайте изменение энергии Гиббса при стандартных условияхи при температуре ТС. Сделайте вывод. В стандартных условиях: 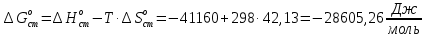 При температуре 250 С: 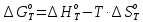 = = 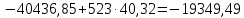 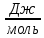 Отрицательное значение изменения энергии Гиббса указывает на возможность протекания прямой реакции как при стандартных условиях, так и при температуре 250С Ответ:  Рассчитайте изменение энергии Гельмгольца при стандартных условиях и при температуре ТС. Сделайте вывод. В стандартных условиях: 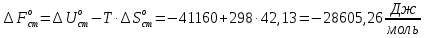 При температуре 250 С: 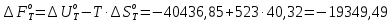 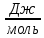 Отрицательное значение изменения энергии Гельмгольца указывает на протекание необратимой самопроизвольной реакции как при стандартных условиях, так и при температуре 250С Ответ: 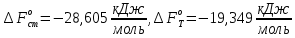 Рассчитайте температуру при которой система будет находиться в равновесии при р,Т=сonst, соответствующих стандартным условиям? Найдем температуру, при которой энергия Гиббса равна нулю:  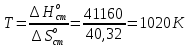 Следовательно, при температуре 747С начнется реакция взаимодействия оксида углерода с водяным паром. Ответ: Т = 747С Рассчитайте константу равновесия при стандартных условиях и при температуре ТС. Сделайте вывод. В стандартных условиях: 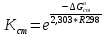 = =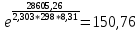 При температуре 250 С:  = =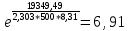 Константа равновесия больше 1, поэтому равновесие смещено в сторону продуктов реакции. Чем константа равновесия больше, тем с большей полнотой происходит прямая реакция. Ответ: 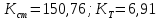 |
