био. Реферат. Доклад з теми Повехневі явища поверхневого натягу рідини у медицині Виконала Студентка групи Пономаренко Діана
 Скачать 61.83 Kb. Скачать 61.83 Kb.
|
|
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ Медичний коледж Запорізького державного медичного університету Доклад з теми: ‘’Повехневі явища поверхневого натягу рідини у медицині’’ Виконала: Студентка групи Пономаренко Діана Викладач: Поверхневі явища та їх значення в медицині. Поверхневі явища – це процеси, які відбуваються на межі поділу фаз у гетерогенних системах. За агрегатним станом контактуючих фаз поверхні поділи класифікують на: - рухомі межі поділу: рідина-газ (Р-Г), рідина-рідина (Р-Р) - нерухомі межі поділу: тверде тіло – газ (Т –Г), тверде тіло – рідина (Т – Р), тверде тіло – тверде тіло (Т- Т) В організмі на поверхні поділу фаз відбуваються процеси дихання, обміну, адсорбції, десорбції, ферментні реакції. Властивості молекул на поверхні поділу рідина – газ, відрізняються від властивостей молекул в об’ємі рідкої фази. Якщо молекула знаходиться всередині рідини, вона рівномірно притягується з усіх боків такими самими за природою молекулами і силове поле міжмолекулярної взаємодії скомпенсоване. На молекулу, що знаходиться поблизу поверхні поділу фаз, з боку газоподібної фази діють слабші сили притягання, ніж з боку рідкої фази, отже положення такої молекули не скомпенсоване. При попаданні молекули рідина на поверхню поділу фаз неврівноваженість молекулярної взаємодії зростає. Енергетична некомпенсованість молекул на межі поділу фаз призводить до втягування тих молекул, що розташовані на поверхні, у глибину рідини. Внаслідок цього виникає сила, під дією якої поверхня рідини на межі поділу рідина – газ зменшується до мінімальної розмірів, а молекули, що розташовані, наближаються до молекул нижчих шарів. При цьому відстань між молекулами поверхневого шару менша, ніж між молекулами внутрішніх шарів. Молекули, розташовані на поверхні, не повністю реалізують свою здатність до взаємодії і тому мають певний надлишок енергії, який називають вільною поверхневою енергією Gs.. Відношення надлишку вільної поверхневої енергії Гіббса до одиниці площі поділу фаз називають поверхневим натягом σ = Gs / S де Gs – вільна поверхнева енергія, S – поверхня поділу фаз, σ – поверхневий натяг Поверхневий натяг вимірюють в кілоджоулях на квадратний метр (кДж/м2) або в ньютонах на метр (Н/м). Кожна чиста рідина за сталої температури має певну величину поверхневого натягу, яка залежить від її природи. Поверхневий натяг багатьох рідин лінійно зменшується з підвищенням температури. При розчиненні в воді речовин відбувається зміна її поверхневого натягу. За характером впливу на поверхневий натяг речовини поділяються на три групи. До першої відносяться речовини які зменшують поверхневу активність води. Їх називають поверхнево-активними (ПАР). Це карбонові кислоти, спирти, аміни. Речовини які збільшують поверхневий натяг називаються поверхнево-неактивними (ПНР). До них відносяться деякі сильні електроліти (неорганічні кислоти, основи , солі), а також деякі сильні полярні органічні сполуки (гліцерин, амінокислоти). Речовини які не впливають на поверхневий натяг води, називаються поверхнево-індиферентними. Прикладом таких речовин є сахароза та інші вуглеводи. Поверхнева активність ПАР залежить від їх молекулярної маси. Згідно правила Дюкло – Траубе: поверхнева активність жирних кислот, спиртів та інших дифільних сполук у водних розчинах однакової концентрації зі збільшення довжини вуглеводневої групи на одну групу – СН2- збільшується у 3 – 3,5 рази. Це привило найбільш точно використовується на низьких концентраціях розчинених речовин. Із нього можна зробити висновок: площа яка припадає на одну молекулу максимально насиченого ПАР адсорбційного шару, залишається в межах гомологічного ряду. За значеннями максимальної адсорбції Гмах можна розрахувати розміри молекул ПАР: А) поперечний переріз полярної групи ( площу): S0 = 1/ Гмах Na Де S0 – площа поверхні, яку займає одна молекула; Na – стала Авогадро, Гмах - число моль ПАР у моно шарі при граничній адсорбції Б) довжину молекули l = Гмах M / ρ де Гмах – число моль ПАР у моно шарі за граничної адсорбції; M – молярна маса; ρ – густина ПАР. Адсорбція. Адсорбція на межі рідина – газ і рідина – рідина. При порівнянні будови молекул ПАР з будовою ПНР і ПІР, необхідно відмітити таку особливість ПАР, як дифільність, обумовлену наявністю в цих молекулах і гідрофільної частини – здатної до гідратації полярної групи ( -СООН, -SO3H, -OH, -NH2) і гідрофобної – неполярної вуглеводневої частини. Молекули ПАР потрапивши у воду виштовхуються в поверхневий шар, орієнтуючись своїми полярними групами до води, а неполярними – в бік повітря, внаслідок чого і відбувається зменшення поверхневого натягу. В залежності від здатності до дисоціації ПАР можуть бути електролітами та неелектролітами. Перші з них називаються іоногенними, другі неіоногенними. В свою чергу серед іоногенних виділяють катіоноактивні, аніоноактивні і амфотерні. Катіоноактивні і аніоноактивні застосовують в хірургії як антисептики. Антисептична дія ПАР пояснюється їх впливом на проникність клітинних мембран, а також інгібуючою дією на ферментні системи мікроорганізмів. ПАР активно застосовують в фармацевтичній промисловості як основа для виготовлення супозиторіїв і мазей, як стабілізатори емульсій. Зменшення поверхневого натягу рідини при додаванні ПАР відбувається за рахунок їх накопичення в поверхневому шарі. Поверхневий натяг багатьох рідин лінійно зменшується з підвищенням температури, оскільки середня відстань між молекулами збільшується, внаслідок чого послаблюються сили взаємодії між молекулами, що призводить до зменшення поверхневого натягу. Виходячи з цієї закономірності, Д. І. Менделєєв встановив, що за певної критичної температури (температури кипіння) величина поверхневого натягу дорівнює нулю. Залежність поверхневого натягу рідин від температури має вигляд: 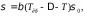 де β – коефіцієнт пропорційності; ∆ – константа; Ткр і Т – відповідно критична і температура досліду; σ0 і σТ – відповідно поверхневий натяг за початкової та кінцевої температури. Поверхневий натяг вимірюють в кілоджоулях на квадратний метр (кДж/м2) або в ньютонах на метр (Н/м). Кожна чиста рідина за сталої температури має певну величину поверхневого натягу, яка залежить від її природи. Поверхневий натяг багатьох рідин лінійно зменшується з підвищенням температури. При розчиненні в воді речовин відбувається зміна її поверхневого натягу. За характером впливу на поверхневий натяг речовини поділяються на три групи. До першої відносяться речовини які зменшують поверхневу активність води. Їх називають поверхнево-активними (ПАР). Це карбонові кислоти, спирти, аміни. Речовини які збільшують поверхневий натяг називаються поверхнево-неактивними (ПНР). До них відносяться деякі сильні електроліти (неорганічні кислоти, основи , солі), а також деякі сильні полярні органічні сполуки (гліцерин, амінокислоти). Речовини які не впливають на поверхневий натяг води, називаються поверхнево-індиферентними. Прикладом таких речовин є сахароза та інші вуглеводи. Поверхнева активність ПАР залежить від їх молекулярної маси. Згідно правила Дюкло – Траубе: поверхнева активність жирних кислот, спиртів та інших дифільних сполук у водних розчинах однакової концентрації зі збільшення довжини вуглеводневої групи на одну групу – СН2- збільшується у 3 – 3,5 рази. Це привило найбільш точно використовується на низьких концентраціях розчинених речовин. Із нього можна зробити висновок: площа яка припадає на одну молекулу максимально насиченого ПАР адсорбційного шару, залишається в межах гомологічного ряду. За значеннями максимальної адсорбції Гмах можна розрахувати розміри молекул ПАР: А) поперечний переріз полярної групи ( площу): S0 = 1/ Гмах Na Де S0 – площа поверхні, яку займає одна молекула; Na – стала Авогадро, Гмах - число моль ПАР у моно шарі при граничній адсорбції Б) довжину молекули l = Гмах M / ρ де Гмах – число моль ПАР у моно шарі за граничної адсорбції; M – молярна маса; ρ – густина ПАР При порівнянні будови молекул ПАР з будовою ПНР і ПІР, необхідно відмітити таку особливість ПАР, як дифільність, обумовлену наявністю в цих молекулах і гідрофільної частини – здатної до гідратації полярної групи ( -СООН, -SO3H, -OH, -NH2) і гідрофобної – неполярної вуглеводневої частини. Молекули ПАР потрапивши у воду виштовхуються в поверхневий шар, орієнтуючись своїми полярними групами до води, а неполярними – в бік повітря, внаслідок чого і відбувається зменшення поверхневого натягу. В залежності від здатності до дисоціації ПАР можуть бути електролітами та неелектролітами. Перші з них називаються іоногенними, другі неіоногенними. В свою чергу серед іоногенних виділяють катіоноактивні, аніоноактивні і амфотерні. Катіоноактивні і аніоноактивні застосовують в хірургії як антисептики. Антисептична дія ПАР пояснюється їх впливом на проникність клітинних мембран, а також інгібуючою дією на ферментні системи мікроорганізмів. ПАР активно застосовують в фармацевтичній промисловості як основа для виготовлення супозиторіїв і мазей, як стабілізатори емульсій. Зменшення поверхневого натягу рідини при додаванні ПАР відбувається за рахунок їх накопичення в поверхневому шарі. АДСОРБЦІЯ. ІЗОТЕРМА АДСОРБЦІЇ. РІВНЯННЯ ГІББСА. ПН розчинів звичайно відрізняється від ПН розчинника. Розчинена речовина може не змінювати , підвищувати й знижувати його. Поверхнева вільна енергія прагне до мінімуму, тому при підвищенні речовина буде віддалятися з поверхні усередину рідини. Повному видаленню молекул розчиненої речовини з поверхні перешкоджає тепловий рух, під дією якого речовина прагне до рівномірного розподілу в об'ємі. Під впливом цих двох факторів установлюється рівновага, у результаті якого концентрація речовини в поверхневому шарі зменшується в порівнянні з концентрацією в об'ємі. Якщо розчинена речовина знижує , то концентрація його в поверхневому шарі збільшується. Мимовільна зміна концентрації речовини в поверхневому шарі, віднесене до одиниці поверхні, називається адсорбцією, позначається через Г и виражається в кмоль/м2, або моль/см2. Якщо Г>0 адсорбцію називають позитивною, якщо Г<0 - негативної. Якщо розчинена речовина не змінює , адсорбція Г=0 і речовина рівномірно розподілена між поверхневим шаром і об'ємом. Просте термодинамічне співвідношення між поверхневою концентрацією Г и зміною ПН із активною концентрацією речовини, що розчиняється, було виведено Гіббсом: 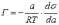 де: а - активність розчину; R- універсальна газова постійна; T - абсолютна температура. Для розведених розчинів активність заміняють концентрацією С: З рівняння випливає, що тільки ті речовини показують позитивну адсорбцію, з підвищенням концентрації яких ПН знижується, <0. Якщо >0, концентрація розчиненої речовини в поверхневому шарі буде зменшуватися: Г<0. Речовини, що підвищують ПН, називаються негативно поверхнево-активними речовинами (інактивними, ними є неорганічні солі). Речовини, що знижують ПН називають поверхнево-активними (ПАР) ДО ПАР відносяться органічні речовини, молекули яких побудовані з ділянок з різко, що розрізняються властивостями. Одна частина молекули полярна, інша - неполярна (вуглеводний радикал). Полярна: -OH, -COOH, -SO3Na, -SO3H, -NH2, -SO2H. Полярна частина гідрофільна, неполярна - гідрофобна. ПАР характеризуються величиною ГЛБ (гідрофільно-ліпофільного балансу). Величина , згідно Ребіндеру, є мірою здатності речовини знижувати поверхневу енергію, вона називається поверхневою активністю й позначається . Її розмірність - Н/м. У гомологічному ряді жирних кислот, спиртів і амінів зниження тим більше, чим довше ланцюг. Відповідно до правила Дюкло-Траубе, при подовженні ланцюга на групу СН2 поверхнева активність зростає на границі розчин-повітря в 3-3,5 разів. Для визначення цієї характеристики будують залежність . Використовуючи рівняння Гіббса, будують залежність . Ізотерма адсорбції описується рівнянням Ленгмюра: де: – гранична концентрація речовини, адсорбованого на 1 м2 поверхні, кмоль/м2; - константа рівноваги, рівна відношенню констант швидкостей процесів десорбції й адсорбції. Знаючи Г можна розрахувати площа S, що доводиться на 1 молекулу.Число адсорбованих молекул на 1 м2 становить: 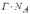 .Звідси: . 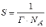 Зі збільшенням Г величина S зменшується й при досягає мінімального значення Sx : 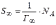 Користуючись Гх обчислюють товщину L насиченого поверхневого шару: 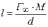 де: M - молекулярна маса; d - густина адсорбованої речовини. Будують ізотерму ПН (залежність від концентрації ПАР). По ізотермі ПН розраховують Г по рівнянню Гіббса. Для цього до кривої 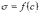 в декількох крапках проводять дотичні до перетинання їх з віссю ординат, проводячи також паралельні прямі до перетинання з віссю ординат (рис. 6.5). Із трикутника АВ знаходять в декількох крапках проводять дотичні до перетинання їх з віссю ординат, проводячи також паралельні прямі до перетинання з віссю ординат (рис. 6.5). Із трикутника АВ знаходять 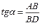 або або 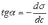 . Знаходять кілька значень . Знаходять кілька значень 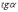 для C1, C2, C3, і будують залежність Г=f(c) для C1, C2, C3, і будують залежність Г=f(c)Кожної концентрації С відповідає відрізок Z на осі ординат. 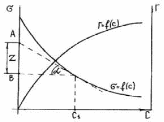 Довжина відрізка, виражена в одиницях ПН дорівнює: 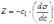 , тому що відповідно до побудови , тому що відповідно до побудови 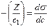 . .Підставивши отримані значення Z у рівняння: 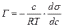 одержимо: 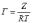 Використовуючи Z для ряду концентрацій, розраховують адсорбцію Г. Будують ізотерму адсорбції, відкладаючи по осі абсцис ІЗ, а по осі ординат Г. Значення Гх визначають графічно по рівнянню Ленгмюра, перетворивши його в рівняння прямої лінії  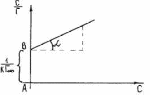 Рис. 3 Графік рівняння Ленгмюра в прямолінійних координатах Кут 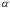 на рис. 4.3 дозволяє визначити на рис. 4.3 дозволяє визначити 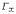 : : 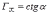 . .Відрізок 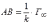 . .Із цього рівняння визначаємо 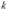 . .З рівняння 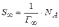 обчислюємо обчислюємо 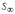 й й 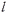 з рівняння з рівняння 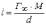 . .Поверхневий натяг рідин Рідина – це такий стан речовини, в якій кінетична енергія хаотичного руху молекул приблизно дорівнює потенціальній енергії їх взаємодії.Розглянемо довільну рідину і визначимо стан молекул на вільній поверхні і всередині рідини. Всередині рідини молекулу з усіх боків симетрично оточують такі ж самі молекули і дія їх компенсується . У молекули, яка знаходиться на поверхні рідини, оточення не симетричне – переважають дії молекул нижчих шарів (рідини). Взаємодія молекули рідини з молекулами повітря і пари над рідиною настільки мала, що нею можна знехтувати. Отже, усі молекули рідини, які містяться в поверхневому шарі, товщина якого дорівнює радіусу сфери молекулярної взаємодії (R = 10-7 см), перебувають під дією певних результуючих сил молекулярних взаємодій, напрямлених всередину рідини. Чим вища молекула в поверхневому шарі, тим більша результуюча сила діє на неї. Ці сили створюють поверхневий молекулярний тиск на рідину. Щоб перейти з середини рідини в поверхневий шар, молекули повинні виконати роботу проти результуючих сил молекулярних дій інших шарів молекул. Через те потенціальна енергія поверхневих молекул збільшується. Весь поверхневий шар має додаткову енергію, яка є складовою частиною внутрішньої енергії рідини. Оскільки положенню рівноваги відповідає мінімум потенціальної енергії, то рідина прагне скоротити площу поверхневої плівки і приймає форму кулі, коли на неї не діють ніякі сили. Сили, які зумовлюють таке скорочення поверхневої плівки рідини, називаються силами поверхневого натягу. Сила поверхневого натягу рідини пропорційна довжині лінії, яка обмежує поверхню: Fп = s l. Тут: Fп – сила поверхневого натягу, яка діє вздовж поверхні рідини по дотичній до неї і перпендикулярна до лінії, яка обмежує цю поверхню l – довжина лінії , що обмежує поверхню рідини.s - коефіцієнт поверхневого натягу. Коефіцієнт поверхневого натягу s чисельно дорівнює силі поверхневого натягу, яка діє на одиницю довжини лінії контуру. Він вимірюється в Н/м. Якщо коефіцієнт поверхневого натягу визначати через роботу або енергію, то: s = або s = , тому що А = DWn. При такому визначенні [s]= Дж/м2. Коефіцієнт поверхневого натягу рідини s залежить від природи рідини, температури і наявності в рідині поверхнево-активних речовин (сіль, мило і таке інше). Наводимо значення s для деяких рідин: Вода – 0,072 Н/м. Жовч – 0,048 Н/м. Сеча – 0,066 Н/м. Спирт – 0,022 Н/м. Коефіцієнт поверхневого натягу s біологічних рідин служить діагностичним показником. Наприклад, при появі в сечі жовчних кислот при захворюванні жовтухою s сечі різко зменшується. Явище змочування і незмочування рідиною твердого тіла є наслідком поверхневого натягу рідини. Висновок Поверхневі явища – це процеси, які відбуваються на межі поділу фаз гетерогенних систем. Поверхневі явища відіграють надзвичайно велику роль у медицині і фармації. Більшість біологічних систем є гетерогенними з надзвичайно великою кількістю поверхней поділу, на яких відбуваються процеси обміну, синтезу, адсорбції, ферментативні реакції та інші процеси, пов'язані з життєдіяльністю організму. Поверхневі явища лежать в основі технології лікарських засобів (одержання, стабілізація, очищення). Широке застосування у фармації знаходять адсорбенти, що утворюють окрему групу лікарських речовин для виведення з організму токсичних речовин, промивання ран, нормалізації кишкової діяльності. Завдяки спільним дослідженням фізико-хіміків і медиків розроблений новий метод лікування людей з тяжкими захворюваннями та отруєннями, оснований на поглинанні із крові (або плазми, лімфи) токсичних речовин і названий гемосорбцією. Поверхневий натяг вимірюється поверхневою енергією, віднесеною до площі поверхні і виражається в Дж/м2 чи Н/м. σ = F/SІнакше кажучи поверхневий поверхневий поверхневий поверхневий натяг - це сила, що намагається скоротити вільну поверхню\тіла до найменшої можливої межі. В чисельному виразі енергетичне і силове визначення сили поверхневого натягу співпадають. Для води ці величини є рівними і складають, відповідно, 7,3⋅10-2 Н/м або (Дж/м2). Поверхневий натяг залежить від температури, природи контактуючих фаз, концентрації розчинених речовин. 1. З підвищенням температури поверхневий натяг на межі рідина-повітря зменшується. 2. Поверхневий натяг визначається і природою рідини, а особливо її полярністю. Саме полярність визначає силу взаємодії між молекулами рідини. Чим більш полярною є рідина, тим вищий у неї поверхневий натяг. Ртуть - 47,2⋅10-2 Н/м, вода 7,3⋅10-2 Н/м, сироватка крові людини - 4,6⋅10-2 Н/м, гексан - 1,8⋅10-2 Н/м. 3. Поверхневий натяг розчинів відрізняються от такого у чистого розчинника. Речовина, які зменшують поверхневий натяг рідин називаються поверхнево-активними (ПАР), речовина, які не змінюють чи навіть збільшують поверхневий натяг рідин називаються поверхнево-інактивними Поверхнева активність дифільних молекул залежить від довжини вуглеводневого радикала. Причому поверхнева активність з подовженням вуглеводневого радикала на атом вуглецю підвищується в 2-3,5 рази (правило Дюкло-Траубе). Література Фролов Ю. Г. Курс колоїдної хімії. - ТОВ ТИД "Альянс", 2004. В.М. Захарченко.Коллоидная хімія. М: Вищу школу, 1989 р Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Донецьк : Донбас, 2004. |
