Движение электрона в атоме
 Скачать 105.5 Kb. Скачать 105.5 Kb.
|
|
Движение электрона в атоме. Согласно квантовой механике, область пространства в электронном облаке, в которой вероятность нахождения электрона наибольшая, называется орбиталью. Формы электронных облаков: 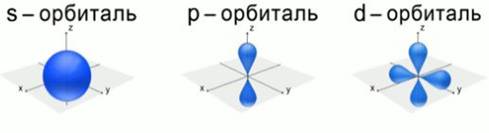 f-орбиталь имеет более сложную форму. 1. s-форма электронного облака (s – «sharp» - резкая, отчётливая) (s-орбиталь) – «шарообразного» вида. 2. p форма электронного облака (p – «principal» - главная) (p-орбиталь) – вида «объёмной симметричной восьмерки». 3. d-форма электронного облака (d – «diffuse» - диффузная, размытая) (d-орбиталь) – вида «простого цветка». 4. f-форма электронного облака (f – «fundamental» - основная) (f-орбиталь) – вида «сложного цветка». Положение электронных облаков в пространстве. 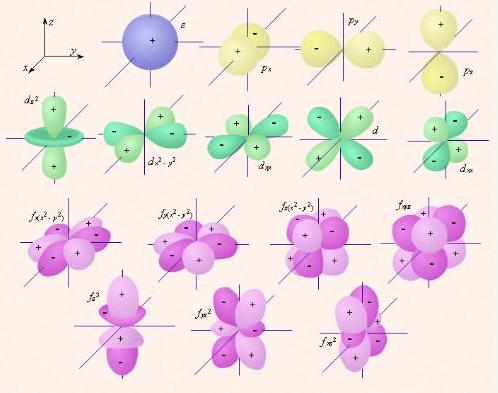 s     -орбиталь имеет одно положение в пространстве. -орбиталь имеет одно положение в пространстве.
d-орбиталь имеет пять положений в пространстве.
f-орбиталь имеет семь положений в пространстве.
П     равило 1: На одной орбитале может быть не более двух электронов и, обязательно, с противоположными спинами. равило 1: На одной орбитале может быть не более двух электронов и, обязательно, с противоположными спинами.
Обозначения:
↑↑ нельзя ↑↑↑ Состояние электронов в атоме: энергетические уровни и подуровни. Одни электроны притягиваются к ядру с большей силой, поэтому располагаются ближе к ядру и имеют меньший запас энергии, а другие притягиваются с меньшей силой и располагаются дальше от ядра и имеют больший запас энергии. Следовательно, электроны, имеющие приблизительно одинаковый энергию запаса располагаются на примерно одинаковом удалении от ядра, т.е. они составляют определённый энергетический уровень. Но и на каждом энергетическом уровне электроны с примерно одинаковым запасом энергии имеют ещё и разной формы электронные облака (орбитали). Т.е. энергетические уровни подразделяют ещё и на энергетические подуровни: s-подуровень, p- подуровень, d- подуровень и f- подуровень. Правило 2: Количество энергетических подуровней на уровне равно номеру данного энергетического уровня.  Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей. На каждом уровне и подуровне может помещаться только определенное количество электронов. Энергии орбиталей одного подуровня одинаковы. 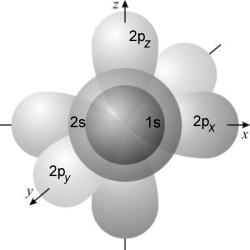 Рис. 2-19. Орбитали атомов элементов, заполняющих свою внешнюю электронную оболочку на 2-м уровне. У таких атомов, как N, O, F и Ne электроны присутствуют на каждой из изображенных орбиталей. Во всех моделях атома электроны называют s-, p-, d- и f-электронами в зависимости от подуровня, на котором они находятся. Элементы, у которых внешние (то есть наиболее удаленные от ядра) электроны занимают только s-подуровень, принято называть s-элементами. Точно так же существуют p-элементы, d-элементы и f-элементы. N = 2∙n2 Эта формула показывает максимальное число электронов (N) на определённом энергетическом уровне(n). При обозначении подуровней к символу подуровня добавляется номер слоя (электронного уровня), например: 2s, 3p, 5d означает s-подуровень второго уровня, p-подуровень третьего уровня, d-подуровень пятого уровня. РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ ПО ЭНЕРГЕТИЧЕСКИМ УРОВНЯМ
|
