|
|
Теория горения и взрыва. Экзамен по теории горения и взрыва Виды горения
Экзамен по теории горения и взрыва
1.Виды горения
Горение - это интенсивная химическая окислительная реакция, сопровождающаяся выделением тепла и пламени.
В зависимости от агрегатного состояния исходного вещества и продуктов горения различают гомогенное горение, горение взрывчатых веществ и гетерогенное горение.
Гомогенное горение – это исходные вещества и продукты горения находятся в одинаковом агрегатном состоянии.
Горение взрывчатых веществ связано с переходом вещества из конденсированного состояния в газообразное.
Гетерогенное горение – исходные вещества находятся в разных агрегатных состояниях.
Движение пламени по газовой смеси называется распространением пламени. И в зависимости от скорости может быть дефлаграционным (несколько м/с), взрывным (сотни м/с), детонационным (тысячи м/с).
Для дефлаграционного (нормального) распространения горения характерны: передача тепла от слоя к слою, при этом пламя перемещается в направлении исходной горючей смеси. Этот вид горения в свою очередь на ламинарное и турбулентное горение.
При ламинарном горении характерна нормальная скорость распространения пламени, т.е. скорость перемещения фронта пламени относительно несгоревшего газа в направлении перпендикулярна к его поверхности. Эта величина является показателем пожарной опасности и зависит от состава горючей смеси, давления и температуры.
При турбулентном горении происходит завихрение газовых потоков, улучшающие перемешивание реагирующих газов и увеличивающие скорость распространения пламени.
Одной из разновидностей горения является взрывчатое горение(взрыв) – это быстрое превращение вещества, сопровождающееся выделением энергии и образованием сжатых газов, способных производить работу.
Детонация – это процесс химического превращение системы окислитель-восстановитель, представляет собой совокупность ударной волны и следующей за ней зоны химических превращений исходных веществ.
При этом химическая энергия, выделяющаяся в детонационной волне, подпитывает ударную, не давая ей затухать.
В основном явления детонации проявляются при горении газообразных сред в трубах и особую опасность представляет переход детонационной волны из трубопровода в закрытую ёмкость или в полуоткрытую систему (производственные помещения), содержащую детонационные системы, т.к. мгновенно детонирует весь объём смеси.
2. Параметры реакции горения
Горение возникает при наличии горючего вещества, окислителя и источника воспламенения. В реальных условиях окислителем является кислород воздуха. При горении систем, не содержащих газообразных частей и состоящих только из твёрдых или жидких фаз – пламя может не возникать, то есть происходит беспламенное горение или тление.
Окислитель – обычно это кислород воздуха, но могут быть и другие (горение металлов в среде хлора). В зависимости от состава различные горючие вещества требуют определённого количества окислителя.
Теоретически необходимое количество воздуха для получения продуктов полного горения:
Окись углерода 1 кг – 2,5 кг воздуха
Метан 1 кг - 17,2 кг воздуха
Бензин 1 кг – 15 кг воздуха
На практике полное сжигание не может быть осуществлено без избыточного количества воздуха. Оно зависит от методов сжигания и находится в пределах от 15 до 50%.
Продукты горения большинства веществ газообразны и при достаточном количестве воздуха состоят из водяного пара и углекислого газа. Присутствуют также окиси азота и серы в малых кол-вах. В случае недостаточного кол- ва воздуха,т.е. неполного сгорания, в состав продуктов горения могут так же входить метан, окись углерода и водород.
Теплота горения. Каждое горючее вещ-во хар-ся высшей и низшей теплотворной способностью. Высшая теплотворность- это кол-во тепла, кот. Выделится при сгорании и при послед. Конденсации влаги, содерж-ся в продуктах горения. Если влага остается в газообразном, парообразном сост, то это низкая теплотворность.
Температура горения- это температура до которой в процессе горения нагреваются продукты горения и исходного горючего вещ-ва. Если предполагать что все тепло при сгорании топлива идет на нагрев продуктов горения то t горения будет наз-ся теоретической. Действительная температура всегда ниже и определяется следующим:
1)кол-вом тепла, выделяемом при горении.
2)составом и кол-вом продуктов горения
3)кол-вом тепла, отданного в окр.среду.
Скорость горения определяется временем, в течении которого сгорает определённое количество горючего вещества. На практике скорость горения определяется временем в течении которого происходят чисто физические процессы: теплопередачи, излучения, испарения и др. Совокупность всех этих процессов определяет реальную скорость горения, на которую оказывают влияние следующие факторы:
Природа горючего вещества( тв, ж, г)
Концентрация вещества
Давление и температура.
3. Механизм процесса горения (4+5)
4. Тепловое самовоспалменение
Под самовоспламенением понимают равновесный нагрев смеси до температуры, выше которой смесь самостоятельно, без дальнейшего внешнего нагрева, воспламеняется.
Пусть Q+ − скорость тепловыделения в сосуде:
Q+ qke–E/RT,(2.1)
гдеq – тепловой эффект реакции;
k – предэкспоненциальный множитель;
E – энергия активности;
R – газовая постоянная;
T – температура.
Q– − скорость теплопотерь за счёт теплообмена газа со стенкой сосуда:
Q– = α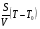 ,(2.2) ,(2.2)
где α − коэффициент теплоотдачи от газа к стенке, S − общая площадь стенки сосуда, V – объём газа в сосуде, T0– температура стенок сосуда.
Обычно в опытах состав смеси и давление задаются заранее, а меняется температура стенок. Для этого случая представлена другая диаграмма (рис. 2.1.).
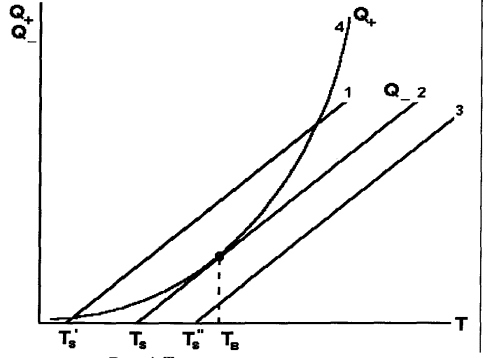
Рис. 2.1. Диаграмма Семёнова. Тs− температура стенки
При постоянном повышении температуры стенки ТSсоответствующая прямая теплоотдачи (Q–) перемещается вправо параллельно самой себе.До тех пор пока прямая теплоотвода пересекает кривую тепловых делений (Q+), разогрев системы стационарен. Выше температуры ТS теплоприход превышает теплоотвод: система прогрессивно разогревается, реагирует, происходит воспламенение. ТS является нижней границей температуры самовоспламенения. Температура, при которой тепловыделение равно
теплоотводу ТВ, называется температурой воспламенения (касание линий). Таким образом, критическое условие возникновения теплового самовоспламенения определяется касанием линий и выражается критерием
Н.Н. Семенова:
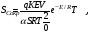 (2.3) (2.3)
где Токр. – температура окружающей среды.
При Se < 1/e – тепловое самовоспламенение не происходит;
Se > 1/е – реакция протекает с самоускорением;
Se = 1/е – критическое значение для возникновения теплового самовоспламенения.
5. Цепные реакции
Цепные реакции − это химические превращения или ядерные процессы, в которых появление промежуточной активной частицы (свободного радикала, атома, возбужденной молекулы – в химических превращениях, нейтрона − в ядерных процессах) вызывает многократное превращение исходных химических веществ или ядерных материалов.
В основе цепного процесса лежит экзоэнергетическая реакция, обладающая тем свойством, что она возбуждается частицей и порождает вторичные частицы. Если в каждом акте реакций появляется только одна частица-носитель, то цепная реакция называется неразветвленной, и она не может стать самоподдерживающейся, если же появляется более одной частицы, то возникает разветвленная цепная реакция, поскольку образуются новые цепи, которые снова ветвятся. Одновременно происходят процессы, которые приводят к обрывам цепей, и если число образующих цепей превосходит число обрывов, то цепная реакция быстро распространяется по всему объему вещества при появлении хотя бы одной начальной частицы и продолжает поддерживать саму себя до полного исчерпания исходных веществ. Примером такой реакции является соединение
Н с О2, когда атом Н отрывает и присоединяет к себе один из атомов О2, образуя свободный радикал ОН. Оставшийся свободным второй атом О2 сразу отрывает и присоединяет к себе один из двух атомов Н, в результате образуется ещё один свободный радикал ОН и свободный атом Н.
Цепными называются химические реакции, протекающие через ряд регулярно повторяющихся элементарных реакций с участием радикалов, атомов или ионов.
Механизм цепных реакций состоит в том, что свободные радикалы, характеризующиеся наличием неспаренных электронов, обладают высокой химической активностью, они легко вступают во взаимодействие с молекулами и приводят их в активное состояние. Эти молекулы, в свою очередь, дают продукты реакции и новые активные частицы, т.е. возникает цепь дальнейших стадий.
Для цепных реакций характерны 3 этапа: зарождение цепи, рост цепи, обрыв цепи. Зарождение цепи заключается в реакции образования радикала, в результате чего появляются активные частицы. Этот процесс требует затрат энергии и может идти при нагреве вещества.
Рост цепи представляет собой периодическое повторение стадий реакции с участием активных частиц (звеньев цепи). Длина цепи зависит от соотношения между числом активных частиц, образующихся в единицу времени, и числом таких же частиц, расходуемых на образование продуктов реакции и на другие процессы.
Обрыв цепи соответствует исчезновению активных частиц. Потеря активности частицами может происходить при адсорбции частиц стенками сосуда, при столкновении двух активных частиц с третьей, называемой ингибитором, которой активные частицы отдают избыточную энергию. Поэтому для цепных реакций характерна зависимость их скорости от размеров, формы и материала реакционного сосуда, от наличия посторонних инертных веществ (ингибиторов) температуры и других факторов.
Скорость разветвленных цепных реакций может быть найдена по уравнению Н.Н. Семенова, открывшего реакции нового типа (разветвление):
W = Aeyt,(2.4)
А = S(Ci),
где Ci – концентрация вещества,
y – положительная величина,
t – время.
Цепное самовоспламенение наблюдается в газовых системах при разветвленных цепных реакциях, при этом концентрация активных час-
тиц n изменяется во времени:
dn/dt = ω0 – (q – f)n, (2.5)
где W0,q,f – константы скорости соответственно зарождения, обрыва и разветвления.
При f >q число частиц растёт экспонециально и реакция резко самоускоряется. Критическое условие f = q (т.е. число разветвлений равно числу обрывов). Константы f и qзависят от температуры и давления, формы и размеров сосудов.
6. Показатели пожарной опасности веществ и материалов
Применяемость показателей определяется агрегатным состоянием и при этом различают:
газы – это вещества давление которых при температуре 50 градусов состовляет более 300 КПа
жидкости – это вещества с температурой капли падения менее 50 градусов.
Твердые вещества – это температура плавления более 50 градусов
Пыли – это диспергированные твердые вещества с размером частиц менее 850 мкм.
Способность веществ к горению:
1 не горючие – вещества и металлы не способные к горению на воздухе;
2 трудногорючие –вещества способные возгараться в воздухе от источника зажигания, но не способные гореть после его удаления.
3 горючие- вещества способные самовозгораться, возгораться от источника зажигания и самостоятельно гореть после удаления.
7. Температура вспышки, самовоспламенения
Температура самовоспламенения − характеризует минимальную температуру вещества, при которой происходит резкое увеличение скорости экзотермических реакций, заканчивающееся возникновением пламенного горения.
Температура вспышки (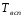 )− наименьшая температура горючей жидкости, при которой в условиях специальных испытаний над её поверхностью образуются пары, способные вспыхнуть в воздухе при поднесении к ним внешнего источника зажигания (пламени или нагретого до высокой температуры тела). Устойчивое горение при этом не устанавливается вследствие малой скорости испарения горючей жидкости. Температура вспышки показывает, при какой температуре вещество подготовлено к воспламенению и становится огнеопасным в открытом сосуде. )− наименьшая температура горючей жидкости, при которой в условиях специальных испытаний над её поверхностью образуются пары, способные вспыхнуть в воздухе при поднесении к ним внешнего источника зажигания (пламени или нагретого до высокой температуры тела). Устойчивое горение при этом не устанавливается вследствие малой скорости испарения горючей жидкости. Температура вспышки показывает, при какой температуре вещество подготовлено к воспламенению и становится огнеопасным в открытом сосуде.
В зависимости от температуры вспышки горючие жидкости подразделяются:
на легковоспламеняющиеся (ЛВЖ) с температурой вспышки не свыше 61 °С в закрытом тигле или не свыше 66 °С в открытом тигле;
горючие (ГЖ) с температурой вспышки паров выше 61 и 66 °С.
ЛВЖ, в свою очередь, делятся на три группы:
особо опасные ЛВЖ − имеющие температуру вспышки от – 18 °С и ниже в закрытом тигле или – 13 °С и ниже – в открытом;
постоянно опасные ЛВЖ − имеющие температуру вспышки от
–18 ° до +23 °С в закрытом тигле или от – 13 ° до +27 °С − в открытом;
опасные при повышенной температуре ЛВЖ. К данному разряду относятся жидкости с температурой вспышки от +23 ° до +61 °С включительно в закрытом тигле или от +27 ° до +66 °С − в открытом.
Температура воспламенения (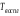 ) − наименьшая температура вещества, при которой в условиях специальных испытаний оно выделяет горючие пары и газы с такой скоростью, что при воздействии на них источника зажигания наблюдается способность воспламениться при поднесении внешнего источника воспламенения. Разница между температурой вспышки и воспламенения для ЛВЖ составляет 1−2 °С, для ГЖ − ) − наименьшая температура вещества, при которой в условиях специальных испытаний оно выделяет горючие пары и газы с такой скоростью, что при воздействии на них источника зажигания наблюдается способность воспламениться при поднесении внешнего источника воспламенения. Разница между температурой вспышки и воспламенения для ЛВЖ составляет 1−2 °С, для ГЖ −
до 10−15 °С и более.
Горение сопровождается выделением тепла, продуктов сгорания и свечением. Для устойчивого горения необходимо, чтобы теплообразование при этом процессе было больше теплоотдачи в окружающую среду. Если в результате горения образуются газы, то горение сопровождается пламенем.
Процесс воспламенения горючих газов и жидкостей без поднесения к ним открытого огня, а только под влиянием внешнего воздействия тепла называется самовоспламенением.
8. Концентрационные пределы самовоспламенения
Взрывная способность горючих газов, паров и пыли в воздухе сохраняется в определенных интервалах их концентраций. Существуют нижние и верхние концентрационные и температурные пределы распространения пламени.
Нижний (верхний) концентрационный предел распространения пламени (НКПРП) − минимальное (максимальное) содержание горючего вещества в однородной смеси с окислительной средой, при которой возможно распространение пламени по смеси на любое расстояние от источника зажигания. Невозможность воспламенения горючей смеси при концентрации ниже НКПРП объясняется малым количеством горючего вещества и избытком воздуха. Чем меньше коэффициент избытка воздуха, тем больше скорость горения и выше давление паров при взрыве. Верхний концентрационный предел распространения пламени характеризуется избытком горючего и малым количеством воздуха. Чем ниже нижний концентрационный предел и больше концентрационная область распространения пламени, тем большую пожарную опасность представляют горючие вещества.
В первом случае взрыв не происходит из-за недостатка горючего вещества, во втором − из-за недостатка воздуха (кислорода), необходимого для окисления горючего вещества.
9. Виды самовозгорания
Самовозгорание присуще всем твердым горючим веществам и материалам.
Самовозгорание – это явление резкого увеличения скорости внутренних (экзотермических) реакций в веществе, приводящее к горению при отсутствии источника зажигания. Если при самовозгорании образуется пламя, то это явление называется самовоспламенением.
Самовозгорание происходит из-за того, что тепловыделение в ходе реакций больше теплоотвода в окружающую среду. Начало самовозгорания характеризуется температурой самонагревания (Тсн), представляющей собой минимальную температуру, при которой обнаруживается тепловыделение.
При достижении в процессе самонагревания определённой температуры, называемой температурой самовозгорания (Тсвоз.), возникает горение материала, проявляющееся либо тлением, либо пламенным горением.
В последнем случае Тсвоз. адекватна температуре самовоспламенения (Тсв.), под которым понимают возникновение горения газов и жидкостей при нагревании до некоторой критической температуры. В принципе самовозгорание и самовоспламенение по физической сущности сходны и различаются лишь видом горения, самовоспламенение возникает только в виде пламенного горения.
В случае самовоспламенения самонагревание развивается в пределах всего нескольких градусов и поэтому не учитывается при оценке пожаровзрывоопасности газов и жидкостей. При самовозгорании область самонагревания может достигать нескольких сотен градусов (например, для торфа от 70 до 225 °С). Вследствие этого явление самонагревания должно учитываться при определении склонности твёрдых веществ к самовозгоранию.
Самовозгорание изучают путём термостатирования исследуемого материала при заданной температуре и установления зависимости между температурой, при которой возникает горение, размерами образца и временем его нагрева в термостате. Процессы, происходящие при самовозгорании образцов горючего материала, изображены на рисунке 3.1.
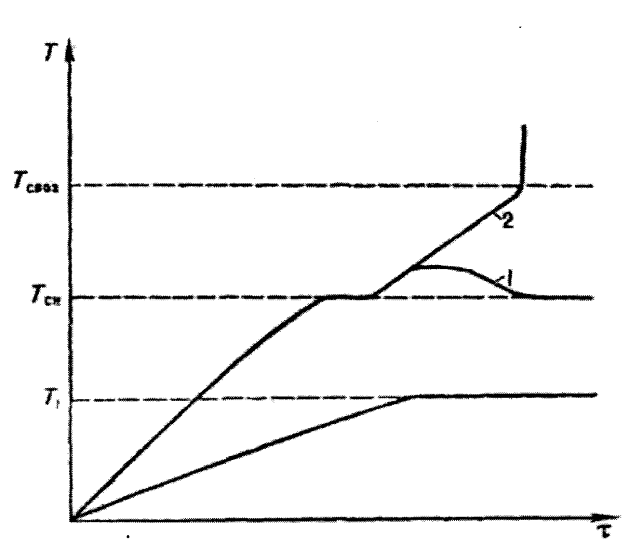
Рис. 3.1. Процессы самовозгорания
Возможность самовозгорания материала, находящегося в потенциально пожароопасной области, устанавливают с помощью уравнений:
lgTокр. = А1 – n1lgℓ,(3.1)
lgTокр. = А2 – n2lgτ,(3.2)
где Токр.− температура окружающей среды, °С; ℓ − определяющий размер (обычно толщина) материала; τ − время, в течение которого может произойти самовозгорание; А1, п1 и А2, п2 − коэффициенты, определяемые для каждого материала по опытным данным (см. табл. 3.1).
По уравнению (3.1) при заданном ℓ находят Токр., при которой может возникнуть самовозгорание данного материала, по уравнению (3.2) при известной Токр. − величину τ.
При температуре, ниже вычисленной Токр., или при τ, меньшем, чем время, рассчитанное по уравнению (3.2), происходит самовозгорание.
В зависимости от природы первоначального процесса, вызвавшего самонагревание материала, и значений Тсн.,различают химическое, микробиологическое и тепловое самовозгорание.
Тепло обыкновенного трубопровода горячей воды или пара
(Т = 100÷150 ºС) может явиться тем источником тепла, которого достаточно для самовозгорания изделий из ткани, бумаги или древесины. Поэтому трубопроводы горячей воды или пара необходимо ограждать только экранами из негорючих материалов. В общественных зданиях допускаются декоративные решетки, но и в первом и во втором случаях расстояние от трубопроводов до экранов, а равно и до любого сгораемого материала (занавески, например) должно быть не менее 100 мм. В производственных условиях самовозгораются каменный уголь, торф, опилки, некоторые горючие жидкости, обычно в виде тонких пленок, получающихся при нанесении жидкости на ворсистые поверхности (хлопок, вата и т. п.). К этим жидкостям относятся растительные масла, скипидар. На предприятиях имеются случаи самовозгорания обтирочных материалов, промасленной спецодежды, поэтому спецодежду необходимо развешивать так, чтобы обеспечить доступ воздуха, для отвода тепла промасленные обтирочные материалы собираются в несгораемую тару с крышками и ежесменно удаляются, сжигаются или уничтожаются. Известны случаи тления и горения угля в кучах, торфа и хлопка, неоднократно отмечены случаи самовозгорания толи в рулонах, целлофана и целлулоида, бумаги, а также материалов.
Общее требование пожарной безопасности для случаев теплового самовозгорания формулируется довольно просто: безопасной температурой длительного нагрева вещества считается температура, не превышающая 90 % температуры самонагревания.
Химическое самовозгорание связано со способностью веществ и материалов вступать в химическую реакцию с воздухом или другими окислителями при нормальных условиях с выделением теплоты, достаточной для их возгорания (например, при попадании кондиционированной азотной кислоты на бумагу, древесные опилки и др.). Наиболее характерными примерами являются случаи самовозгорания промасленной ветоши или фосфора на воздухе, легковоспламеняющихся жидкостей при контакте с марганцовкой, древесных опилок с кислотами и пр. Особенно опасны масла, содержащие соединения с ненасыщенными химическими связями и характеризующиеся высоким йодным числом (хлопковое, подсолнечное, джутовое и т. д.).
Другой вид химических реакций веществ связан с взаимодействием воды или влаги. При этом также выделяется достаточная для самовозгорания веществ и материалов температура. Примерами могут служить такие вещества, как калий, натрий, карбид кальция, негашеная известь и др. Особенностью щелочно-земельных металлов является их способность гореть и без доступа кислорода. Необходимый для реакции кислород они добывают сами, расщепляя под действием высокой температуры влагу воздуха на водород и кислород. Вот почему тушение водой таких веществ приводит к взрыву образующегося водорода. Для предупреждения химического самовозгорания порядок совместного хранения горючих веществ и материалов строго регламентирован.
Склонностью к микробиологическому самовозгоранию обладают горючие материалы, особенно увлажненные, служащие питательной средой для микроорганизмов, жизнедеятельность которых связана с выделением теплоты (торф, древесные опилки и др.). По этой причине большое число пожаров и взрывов происходит при хранении сельскохозяйственных продуктов (например, силос, увлажненное сено) в элеваторах. Для микробиологического и химического самовозгорания характерно то, что Тсн. не превышает обычных значений Токр. и может быть отрицательной. Материалы, имеющие Тсн. выше комнатной температуры, способны к тепловому самовозгоранию.
Склонностью ко всем видам самовозгорания обладают многие твердые материалы с развитой поверхностью (например, волокнистые), а также некоторые жидкие и плавящиеся вещества, содержащие в своем составе непредельные соединения, нанесённые на развитую (в том числе негорючую) поверхность. Все виды самовозгорания имеют чисто условное деление и для большинства горючих веществ процесс самовозгорания представляет собой совокупность тепловой, химической и микробиологической реакции.
|
|
|
 Скачать 294.89 Kb.
Скачать 294.89 Kb.