вопросы по химии. Экзаменационные вопросы по химии
 Скачать 2 Mb. Скачать 2 Mb.
|
|
Экзаменационные вопросы по химии Газообразное состояние вещества. Газовые законы. Химический состав атмосферного воздуха.Газообразное состояние характерно тем, что оно не сохраняет ни форму, ни объём. Причем заполняет весь доступный ему объём. Это состояние, свойственное веществам с малой плотностью. Переход из жидкого в газообразное состояние называют испарением, а противоположный ему переход из газообразного состояния в жидкое — конденсацией. Переход из твёрдого состояния в газообразное, минуя жидкое, называют сублимацией или возгонкой.   Жидкое состояние вещества. Уникальные свойства воды. Причины аномально высокой температуры плавления льда и кипения жидкой воды. Жидкое состояние вещества — это состояние, промежуточное между твердым (кристаллическим) и газообразным. При определенном давлении жидкое состояние конкретного вещества термодинамически устойчиво в определенном интервале температур, который зависит от величины давления и от природы жидкости. Уникальные свойства воды 1. Вода полярная. Молекулы воды полярны, с частичным положительным зарядом на атомах водорода, частичным отрицательным зарядом на кислороде и изогнутой общей структурой. Это связано с тем, что кислород более электроотрицателен, а это означает, что он лучше, чем водород, притягивает электроны. 2. Вода отличный растворитель. Вода обладает уникальной способностью растворять многие полярные и ионные вещества. Аномально высокие температуры кипения воды и плавления льда связаны с тем, что молекулы воды способны соединяться в агрегаты с помощью водородных связей. Твердые вещества в аморфном и кристаллическом состоянии. Типы кристаллических решеток. Твердое тело — это одно из четырех агрегатных состояний вещества, отличающееся от других агрегатных состояний (жидкости, газов, плазмы) стабильностью формы и характером теплового движения атомов, совершающих малые колебания около положений равновесия. Аморфные твердые тела — тела, у которых отсутствует порядок расположения атомов и молекул по всему объему этого вещества. В отличие от кристаллических веществ, аморфные вещества изотропны. Это значит, что свойства одинаковы по всем направлениям. В этом состоянии невозможно обнаружить даже малые области, в которых наблюдалась бы зависимость физических свойств от направления. Переход из аморфного состояния в жидкое происходит постепенно, отсутствует определенная температура плавления. Аморфные тела не обладают упругостью, они пластичны. В аморфном состоянии находятся различные вещества: стекла, смолы, пластмассы. Аморфное состояние — неустойчивое состояние твердых тел. Будучи предоставленными сами себе, они стремятся со временем перейти в кристаллическую форму, хотя этот процесс может занимать годы и даже десятилетия. Кристаллические решетки Кристаллическое строение характеризуется правильным расположением частиц в определенных точках пространства. При соединении этих точек воображаемыми прямыми линиями образуется так называемая кристаллическая решетка Точки, в которых размещены частицы, называются узлами кристаллической решетки. В узлах кристаллической решетки могут находиться ионы, атомы или молекулы. В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними различают четыре типа кристаллических решеток: ионные, атомные, молекулярные и металлические. ИОННАЯ РЕШЕТКА Эту решетку образуют все вещества с ионным типом связи — соли, щелочи, бинарные соединения активных металлов с активными неметаллами (оксиды, галогениды, сульфиды), алкоголяты, феноляты, соли аммония и аминов. Примеры: КОН, СаСО33, СН33СООК, NH44NO33, [CH33NH33]Cl, С22Н55ОК. В узлах решетки — ионы, между которыми существует электростатическое притяжение. Ионная связь очень прочная. Металлы, их физико-механические и электрические свойства Свойства металлов делятся на физические, химические, механические и технологические. К физическим свойствам относятся: цвет, удельный вес, плавкость, электропроводность, магнитные свойства, теплопроводность, расширяемость при нагревании. К химическим – окисляемость, растворимость и коррозионная стойкость. К механическим – прочность, твердость, упругость, вязкость, пластичность. Электрические свойства металлов характеризуются электропроводностью и обратным ей свойством – электрическим сопротивлением. Атомы и их строение. Квантовые числа и квантовые правила заполнения электронами атомных орбиталей. Модели атомов в основном и гибридном состоянии. Атом-микросистема, которая состоит из + заряженного ядра и - заряженный электронов, которые двигаются в поле ядра. Ядро-микросистема, которая состоит из протонов и нейронов.   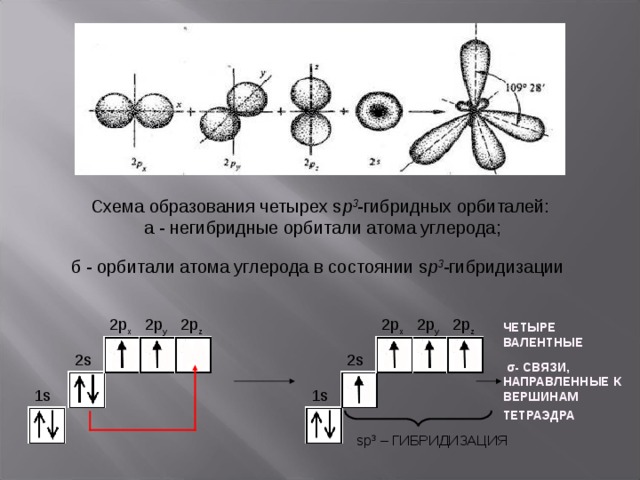 Периодическая система химических элементов. Периодические свойства элементов: атомные радиусы, энергия ионизации, сродство к электрону, электроотрицательность. Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда их атомного ядра. Такие свойства атомов, как их размер, энергия ионизации, сродство к электрону, электроотрицательность, связаны с электронной конфигурацией атома. В их изменении с увеличением порядкового номера элемента наблюдается периодичность. Радиус атома – важная характеристика. Чем больше атомный радиус, тем слабее удерживаются внешние электроны. Типы и характеристики химической связи. Положения метода валентных связей.  Основные положения метода валентных связей: химическая связь между двумя атомами возникает в результате перекрывания атомных орбиталей (АО) с образованием электронных пар (обобществления двух электронов) энергия обмена электронами между атомами (в результате перекрывания орбиталей) вносит основной вклад в энергию химической связи в соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с антипараллельными спинами характеристики химической связи (энергия, длина, полярность и др.) определяются типом перекрывания АО Пространственная структура молекул. Гибридизация. Модели молекул метана, воды и аммиака. Пространственное строение молекул - это взаимное расположение атомов и атомных групп в трехмерном пространстве. Гибридизация — это выравнивание формы и энергии электронных орбиталей разных типов. В результате гибридизации электронные орбитали изменяют свою форму. Они выравниваются и становятся одинаковыми (гибридными). Такие орбитали похожи на неправильные восьмёрки.   (метан) (метан) 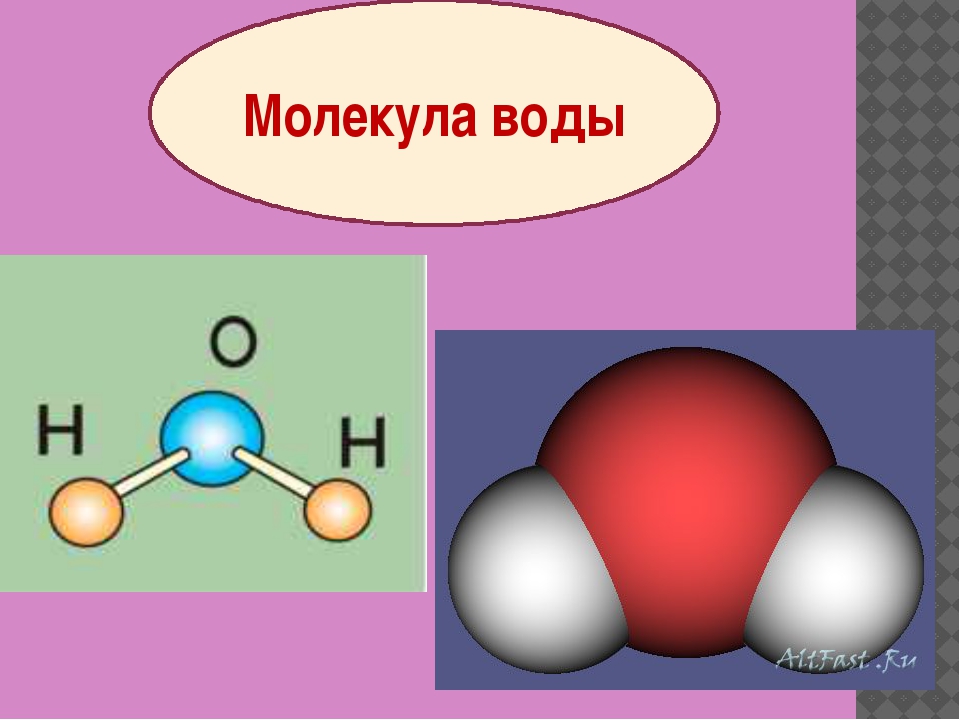 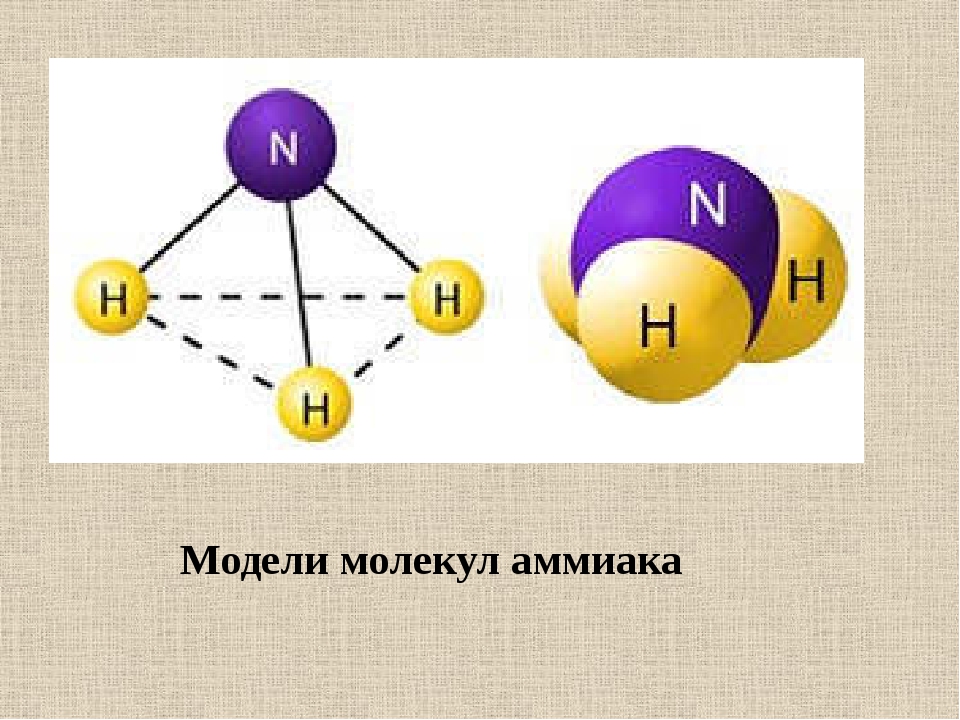 Термодинамика, ее основные понятия: внутренняя энергия, температура, теплота, работа. Закон сохранения энергии. Первое начало термодинамики. Термодинамика-это наука о превращениях одних видов энергии и работы в другие. Химическая Термодинамика-часть термодинамики, которая рассматривает превращения энергии и работы при химических реакция. Внутренняя энергия системы U — это общий ее запас, включающий энергию поступательного и вращательного движений молекул, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов, внутриядерную энергию и т.д. Т=(PV) /(nR) для идеального газа ТЕПЛОТА — это энергия, полученная в результате изменения температуры.  Энергетические эффекты реакций. Термохимические расчеты. Закон Гесса. Второе начало термодинамики. Самопроизвольные процессы. Обратимые и необратимые химические реакции. Химическое равновесие. Принцип Ле-Шателье. Фазовые равновесия. Диаграммы состояния. Скорость химических реакций. Молекулярность и порядок химической реакции. Закон действующих масс. Влияние температуры на скорость химических реакций. Уравнение Вант-Гоффа. Энергия активации. Механизмы химических реакций. Цепные реакции. Катализатор и механизмы катализа. Энергетическая диаграмма каталитического процесса. Общие свойства растворов. Закон Рауля. Осмотическое давление. Электролиты. Степень диссоциации. Теория кислот и оснований. Электролитическая диссоциация воды. Водородный показатель. Кислотно-основные индикаторы. Реакции водных растворов электролитов: нейтрализации, осаждения, окислительно-восстановительные с участием металлов, гидролиза солей. Окислительно-восстановительные процессы. Гальванический элемент. Уравнение Нернста. Электролиз. Законы Фарадея. Электролиз расплавов и растворов на примере сульфата натрия. Химическая коррозия. Защита металлов от коррозии. Электрохимическая коррозия. Защита металлов от коррозии. Дисперсные системы и их классификация. Коллоидные растворы, строение мицеллы. Кинетические и электрические свойства коллоидных растворов. Коагуляция. Поверхностно активные вещества. Строение молекул ПАВ. Применение ПАВ. |
