Ферменты Ферменты
 Скачать 81 Kb. Скачать 81 Kb.
|
|
Ферменты Ферменты – это биологические катализаторы. По химической природе ферменты являются белками. Отличие ферментов от небиологических катализаторов (железо, платина и т.д.) заключается в следующем:
Вещество, которое превращается под действием фермента, называется «субстрат». Структурно-функциональная организация ферментов Так как по химической природе ферменты являются белками, то для них характерны все особенности структурной организации белков. Большинство ферментов имеют четвертичную структуру и являются сложными белками. Они состоят из белка – апофермента и кофактора. В роли кофакторов выступают ионы металлов или коферменты. Коферменты – это небольшие органические молекулы, которые принято разделять на 2 большие группы: витаминные и невитаминные. Исходными веществами для образования витаминных коферментов являются витамины. Поэтому недостаточное поступление их с пищей приводит к снижению синтеза этих коферментов и нарушению функционирования соответствующих ферментов. Невитаминные коферменты образуются в организме из промежуточных продуктов обмена веществ. Поэтому недостатка этих коферментов в физиологических условиях не бывает. Классификация коферментов
Характеристика отдельных представителей коферментов Никотинамидные коферменты. Источником их образования служит ниацин (витамин В5, РР, никотинамид). К ним относятся НАД и НАДФ.  Оба кофермента участвуют в реакциях окисления-восстановления, они способны обратимо принимать электроны и протоны. НАД+ является коферментом дегидрогеназ на всех этапах окисления энергетических субстратов в клетке: углеводов, жирных кислот, глицерина, аминокислот, субстратов цикла Кребса. НАДФН2 (НАДФ+ в восстановительной форме) используется как донор водорода в синтетических восстановительных реакциях (синтез холестерина, жирных кислот и т.д.). Схема окисления-восстановления НАД+ (НАДФ+) 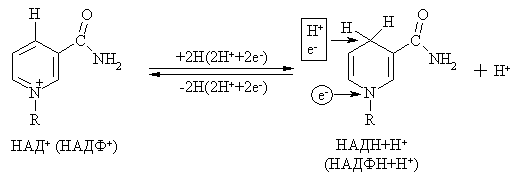 Флавиновые коферменты. Источником их образования является рибофлавин (витамин В5). Из рибофлавина синтезируются ФМН и ФАД. 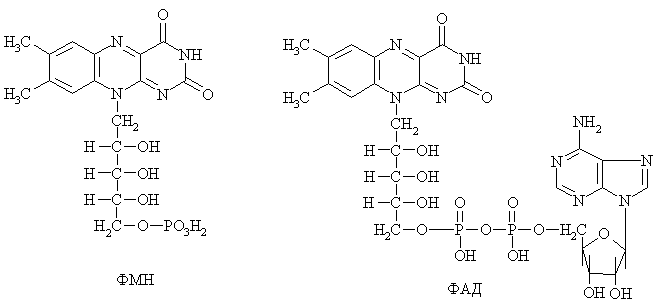 Оба кофермента участвуют в реакциях окисления-восстановления, они способны обратимо принимать электроны и протоны. ФМН и ФАД являются коферментами при переносе электронов и протонов в дыхательной цепи, окислении пирувата, 2-оксоглутарата, сукцината, жирных кислот и т.д. Схема окисления-восстановления фловиновых коферментов 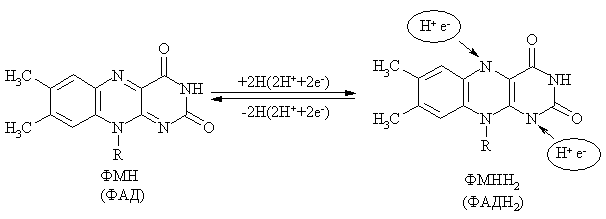 Пиридоксиновые коферменты Источником их образования является пиридоксин (витамин В6). Пиридоксин способен превращаться в пиридоксаль и пиридоксамин, из которых образуется 2 коферментные формы ПАЛФ (пиридоксальфосфат) и ПАМФ (пиридоксаминфосфат).  ПАЛФ – это основная коферментнтная форма витамина В6. Он является коферментом почти для всех классов ферментов: трансфераз, лиаз, изомераз и др. С участием ПАЛФ происходит декарбоксилирование аминокислот и образование биогенных аминов, распад гликогена, взаимопревращение и катаболизм аминокислот и т.д. Пантотеновые коферменты Источником образования пантотеновых коферментов является пантотеновая кислота (витамин В3). В тканях организма происходит образование коферментных форм пантотеновой кислоты, главной из которых является кофермент А. Его сокращенное обозначение KoASH. Группа – SH на конце КоА является рабочей. К ней присоединяются различные группы, чаще других ацильная и ацетильная. С участием KoASH происходят следующие процессы: окисление жирных кислот, синтез холестерина, окисление пирувата и 2-оксоглутарата, синтез кетоновых тел, окисление субстратов в цикле Кребса, обезвреживание биогенных аминов и чужеродных соединений (с помощью ацетилирования) и т.д. Лекция №2Классификация и номенклатура ферментовВ настоящее время существует 2 типа названий ферментов: рабочее, или тривиальное и систематическое. Рабочее название фермента простое и чаще употребляемое. Оно складывается из названия субстрата, типа катализируемой реакции и окончания –аза. Например:  Систематическое название фермента более сложное. Лекция №2Классификация ферментовВсе ферменты разделены на 6 классов:
Оксидоредуктазы – это ферменты, которые катализируют окислительно-восстановительные реакции.
Акцептором атомов водорода могут быть:
 S - субстрат
Например: 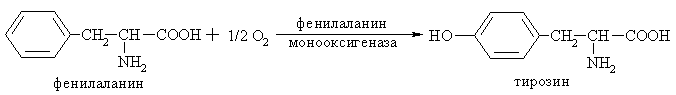
 Трансферазы Трансферазы – это ферменты, которые катализируют реакции переноса различных групп от одного вещества (донора) к другому (акцептору). В организме осуществляется перенос следующих групп: метильных, ацетильных, ацильных, фосфорных и т.д. Рабочее название фермента складывается по принципу: акцептор + переносимая группа + трансфераза. Например:  Трансферазы, которые катализируют реакции переноса фосфорных групп принято называть киназами. Рабочее название киназ складывается из названия акцептора + термин «киназа». Донором фосфатной группы является АТФ. Например: Гидролазы Гидролазы – это ферменты, которые катализируют реакции разрыва связей в субстратах с присоединением воды. Рабочее название фермента в этом классе складывается из названия субстрата + окончание аза 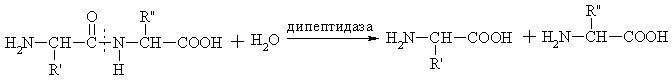 дипептид Все пищеварительные ферменты и ферменты лизосом являются гидролазами. В этом классе много исторически сложившихся или тривиальных названий. Такие названия не подчиняются правилам «Классификации и номенклатуры ферментов». Например, пепсин, трипсин, гастриксин и т.д. Лиазы Лиазы – это ферменты, катализирующие реакции разрыва связей в субстратах путем негидролитического отщепления различных групп (СО2, NH2, Н2О и др.) или присоединения воды по месту двойной связи. Названия ферментов складываются следующим образом: субстрат + отщепляемая или присоединяемая группа + окончание аза
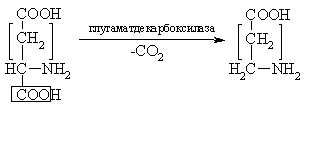 2 2 Глутамат ГАМК
 фумаратгидратаза малат Н
Изомеразы Изомеразы – это ферменты, катализирующие реакции изомеризации, происходящие в пределах одной молекулы. В зависимости от вида изомерии ферментам дают соответствующие названия: рацемазы – катализируют превращения стереоизомеров, эпимеразы – эпимеров, таутомеразы – таутомеров. Мутазы катализируют реакции переноса функциональных групп в пределах одной молекулы. Название этих ферментов складываются следующим образом: название субстрата + название переносимой группы + мутаза.  Некоторые ферменты имеют название изомеразы (например, при цис – транс изомерии). Лигазы Лигазы – это ферменты, катализирующие синтетические реакции, которые происходят с участием энергии АТФ или др. нуклеозидтрифосфатов.  Глутамат Глутамин Название фермента складывается следующим образом: продукт реакции + синтетаза. К этому классу относят карбоксилазы. Присоединение карбоксильной группы к субстрату происходит с затратой энергии АТФ. Название фермента будет состоять из названии исходного субстрата + термин «карбокилаза» 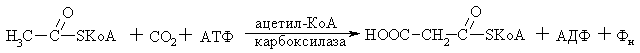 Ацетил-КоА Малонил-КоА |
