Гальванический элемент
 Скачать 261.82 Kb. Скачать 261.82 Kb.
|
|
Гальванический элемент План: 1. Основные понятия и определения 2.Процессы, протекающие на катоде 3.Процессы, протекающие на аноде 4.Рассчет ЭДС гальванического элемента 1. Гальванический элемент — это устройство, которое преобразует химическую энергию в электрическую. В основе работы гальванического элемента лежит окислительно-восстановительная реакция, в которой один электрод отдаёт электроны (процесс окисления), а другой – принимает (процесс восстановления). При этом электрод, отдающий электроды называется анодом, второй электрод, принимающий электроды называется катодом. Оба электрода опущены в растворы своих солей. При работе гальванического элемента анод растворяется, а катод восстанавливается. Важно знать! Гальванический элемент – прибор, который вырабатывает электрическую энергию, а не потребляет. Часто процесс работы гальванического элемента путают с процессов электролиза, в работе которого электрическая энергия затрачивается. В быту примером гальванического элемента является батарейка или автомобильный аккумулятор. Луиджи Гальвани, в честь которого названа гальваническая ячейка, впервые описал «электричество животных» в 1780 году, когда пропускал ток через лягушку. В то время он не знал об этом, но его устройство работало по принципу батареи. Его современник Алессандро Вольта, в честь которого названа «вольтовая ячейка» был убежден, что «животное электричество» исходило не от лягушки, а от чего-то другого, он много работал над этим и в 1800 году изобрел первую настоящую батарею — «вольтовую кучу». Русский ученый-физик Василий Петров в 1802 году соорудил крупнейшую гальваническую батарею в мире, дающую напряжение 1500В. Для сооружения потребовалось около 4200 цилиндров из меди и цинка с диаметром 35.0 мм м толщиной 2.5 мм. Батарея была размещена в ящике из красного дерева, обработанного несколькими слоями различных смол. Опыты Петрова положили начало современной электрометаллургии в дуговых печах. 2. Катодом в гальванических элементах часто служит менее активный металл, который в электрохимическом ряду стоит после водорода. Катод имеет положительный заряд (электроны, как отрицательно заряженные частицы движутся к положительно заряженному катоду) . Катод при работе элемента принимает электроды, при этом электрохимическое уравнение можно записать следующим видом: Кn++nē→К0 – процесс восстановления 3. Анод в гальваническом элементе более активный металл. Если оба элемента в элементе стоят перед водородом, то анодом является элемент, который стоит левее.  Пример: Mg и Fe, то анодом является Mg, так как в ряду он стоит левее и является более активным. При работе гальванического элемента анод обладает отрицательным зарядом и отдает электроны (процесс окисления). Электрохимическое уравнение можно записать следующим видом: А(0)-nē→А(n+) – процесс окисления Пример работы гальванического элемента: 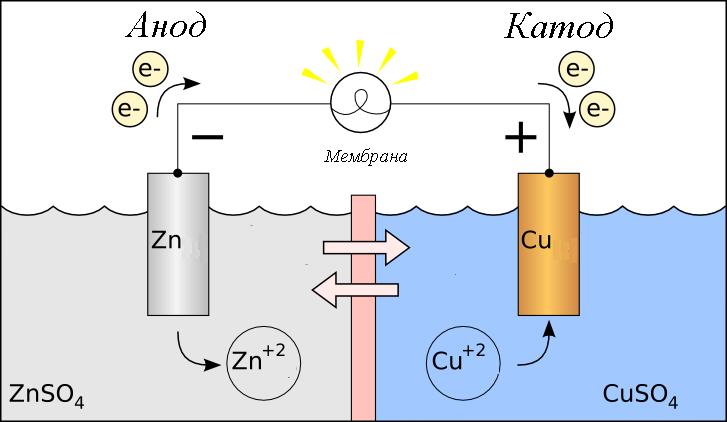 В данном приборе анодом является цинк, а катодом – медь. Так как цинк является более активным металлов и в электрохимическом ряду стоит левее меди. Электролиты, в которые опущены электроды следующие:Zn опущен в раствор своей соли ZnSO4, а медь - в раствор своей соли CuSO4. Растворы электролитов разделены полупроницаемой мембраной, через которую способны проходить ионы. Цинк при работе растворяется и переходит в раствор, а медь из раствора восстанавливается. Электрохимические уравнения записываются следующим образом: А(-) Zn0 - 2ē → Zn+2 K(+) Cu+2+2ē→Cu0 Движение электронов от анода к катоду. Схема гальванического элемента записывается так: Zn0/Zn+2//Cu+2/Cu0 4. Гальванические элементы характеризуются электродвижущей силой (ЭДС), ёмкостью; энергией, которую он может отдать во внешнюю цепь. ЭДС гальванического элемента всегда положительна. При расчеты ЭДС необходимо учитывать концентрацию электролитов, в которые опущены электроды. 1. Стандартные условия. Стандартными условиями считаются те условия, если концентрация электролитов составляет 1моль/л. Тогда ЭДС гальванического элемента рассчитывается по уравнению: ЭДС=Е0К-Е0А, где Е0 – стандартные электродные потенциалы металлов катода и анода. К – катод А - анод Стандартные электродные потенциалы постоянны и являются справочными величинами. Электродные потенциалы рассчитываются в вольтах В. Пример: Рассчитать ЭДС гальванического элемента, составленного из медного и магниевого электродов, опущенных в растворы электролитов CuSO4 и MgSO4 соответственно с концентрацией 1моль/л. Дано: Cu Mg Сm(CuSO4)=1моль/л Сm(MgSO4)=1моль/л __________________ ЭДС-? Решение: Более активным металлом является магний и, следовательно, он в данном гальваническом элементе является анодом. Катодом является медь. Электрохимические уравнения имеют вид: А(-) Mg0-2ē→Mg+2 K(+) Cu+2+2ē→Cu0 Схема гальванического элемента записывается так: Mg0/ Mg+2// Cu+2/ Cu0 ЭДС рассчитывается по уравнению: ЭДС=Е0К-Е0А По справочным данным Е0 А(-) Mg=-2,36В Е0 К(+) Cu=0,34, Следовательно: ЭДС=0,34-(-2,36)=0,34+2,36=2,70В 2. Нестандартные условия. Нестандартными называются условия, в которых электролиты, в которые опущены электроды, имеют концентрацию различную и она не равна 1моль/л. Для таких гальванических элементов ЭДС рассчитывается по формуле: ЭДС=ЕК-ЕА Где Е – нестандартные электродные потенциалы металлов, из которых изготовлены электроды (В). К – катод А - анод Для расчета таких потенциалов используют уравнение Нернста: 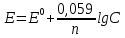 , ,Где Е0 – стандартный электродный потенциал металла n – количество электронов, участвующих в процессе С – концентрация электролита, в который опущен электрод. После расчета электродных потенциалов рассчитывается ЭДС гальванического элемента. Пример: Рассчитать ЭДС гальванического элемента, составленного из медной и цинковой пластин, погруженных в растворы 0.1М CuSO4 и 0,01М ZnSO4 соответственно. Дано: Cu Zn Cm(CuSO4)=0,1моль/л Cm(ZnSO4)=0,01моль/л ____________________ ЭДС-? Решение: Более активным металлом является цинк и, следовательно, он в данном гальваническом элементе является анодом. Катодом является медь. Электрохимические уравнения имеют вид: А(-) Zn0-2ē→Zn+2 K(+) Cu+2+2ē→Cu0 Схема гальванического элемента записывается так: Zn0/ Zn+2// Cu+2/ Cu0 ЭДС рассчитывается по уравнению: ЭДС=ЕК-ЕА По справочным данным Е0 А(-) Mg=-2,36В Е0 К(+) Cu=0,34, По уравнению Нернста рассчитаем электродные потенциалы анода и катода: Для анода: 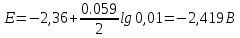 Для катода: 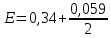 lg0,1=0,302В lg0,1=0,302ВРассчитаем ЭДС гальванического элемента: ЭДС=0,302-(-2,419)=0,302+2,419=2,721В Задания для самостоятельной работы Задания выполняются письменно и выкладываются в электронную среду. 1. Привести типы электродов гальванических элементов. 2. От чего зависит ЭДС гальванического элемента. 3. Из стандартных электродных потенциалов вычислите значение э.д.с. гальванического элемента, составленного из медного и магниевого электродов. Напишите процессы на аноде и катоде. 4. Вычислите ЭДС гальванического элемента, состоящего из двух электродов: Ti0/ Ti2+ // Ni2+ / Ni0. Концентрация солей для титана 0,01 моль/л, для никеля 1 моль/л |
