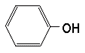бх. Гниение белков в толстом кишечнике. Обезвреживание продуктов гниения в печени
 Скачать 260.05 Kb. Скачать 260.05 Kb.
|
|
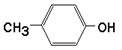
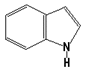
Гниение белков в толстом кишечнике. Обезвреживание продуктов гниения в печени. Часть аминокислот не всасывается и подвергается процессам гниения с участием микрофлоры в толстом кишечнике. Продукты гниения аминокислот могут всасываться и попадают в печень, где подвергаются реакциям обезвреживания. За счет деятельности микрофлоры толстого кишечника а/к подвергаются гниению с образованием ядовитых продуктов: при распаде серусодержащих а/к (цистина, цистеина и метионина) образуются H2S и метилмеркаптан (CH3SH). Диаминокислоты, в частности орнитин и лизин, подвергаются декарбоксилированию с образованием протеиногенных аминов (трупных ядов). 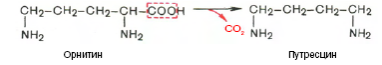 При разрушении фенилаланина, тирозина, триптофана, образуются соответствующие биогенные амины: фенилэтиламин, триптамин, серотонин. При разрушении этих же аминокислот могут образовываться крезол, фенол, скатол, индол, бензол.  Все эти вещества гидрофобны и обладают мембранотропным действием (поражают мембраны клеток печени, эритроцитов, легких). Продукты распада аминокислот поступают в печень, где подвергаются детоксикации. В печени эти продукты обезвреживаются путем конъюгации с серной или глюкуроновой кислотой с образованием нетоксичных парных кислот (фенолсерная, скатоксилсерная). 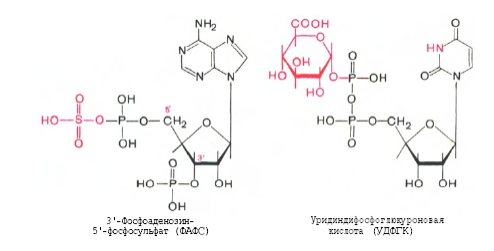 Происходит это так: в печени содержатся специфические ферменты - арилсульфотрансфераза и УДФ-глюкуронилтрансфераза, которые катализируют перенос остатка серной кислоты из ее связанной формы-ФАФС (фосфоаденозин-фосфосульфат) и остатка глюкуроновой кислоты из ее связанной формы-УДФГК (уридиндифосфоглюкуроновой кислоты) на любой из указанных выше продуктов. Продукты реакции нетоксичные так называемые парные кислоты (например, фенолсерная кислота, скатоксилсерная), выделяются с мочой. Диагностическое значение индикана: он характеризует содержимое кишечника. Содержание индикана увеличивается при запорах, непроходимости кишечника, при перитонитах и парезах кишечника. В этих случаях индикан появляется в крови и выделяется с мочой в повышенных количествах. Увеличение его концентрации в крови наблюдается на ранних стадиях почечной недостаточности. Продукты гниения аминокислот в кишечнике.
Катаболизм аминокислот в толстом кишечнике В некоторых ситуациях, а именно: при ухудшении всасывания аминокислот, при избытке белковой пищи, при нарушении деятельности пищеварительных желез, при снижении перистальтики кишечника (запоры) аминокислоты и недопереваренные фрагменты белков достигают толстого кишечника, где подвергаются воздействию кишечной микрофлоры. Такой процесс получил название гниение белков в кишечнике. При этом образуются продукты разложения аминокислот, представляющие собой токсины (аммиак, кадаверин, путресцин, крезол, фенол, скатол, индол, пиперидин, пирролидин, сероводород (H2S), метилмеркаптан (СН3SН) и другие), нейромедиаторы (серотонин, гистамин, октопамин, тирамин, триптамин). Детоксикация продуктов гниения Обезвреживание токсических веществ, поступающих из толстого кишечника, происходит в печени с помощью двух систем: система микросомального окисления, система конъюгации. Цель работы системы микросомального окисления заключается в увеличении реакционной способности молекулы и ее возможности вступить в реакцию конъюгации, в придании гидрофильности молекуле, что способствует ее выведению с мочой и отсутствию накопления в нервной и жировой ткани. Цель работы системы конъюгации заключается в маскировке реакционноспособных и токсичных групп (например, в феноле это ОН-группа). 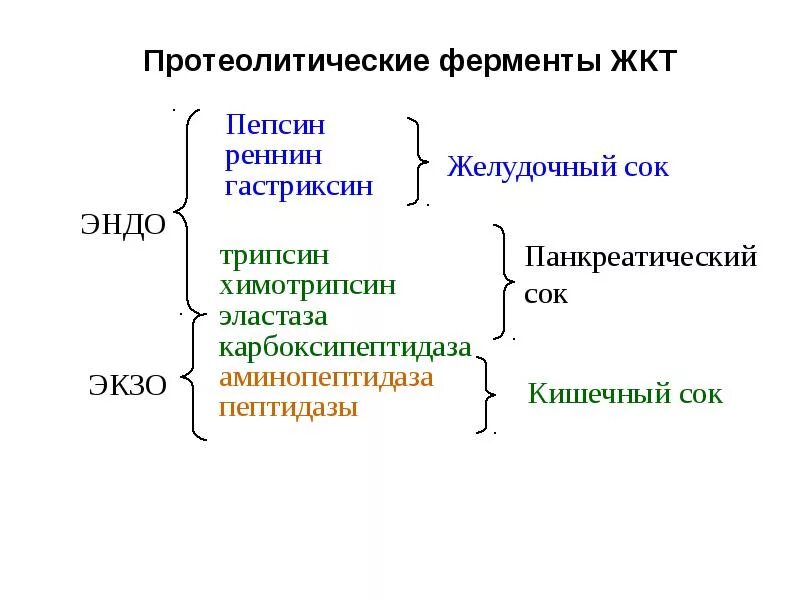 Активация зимогенов. Активация зимогенов.Многие пищеварительные ферменты синтезируются в неактивной форме – в виде зимогенов (пепсиноген, трипсиноген и др.). Эти неактивные зимогены активируются после попадания в ЖКТ, благодаря этому не происходит переваривания клеток, где происходит синтез ферментов. Зимогены не активны, так как содержат дополнительные участки или группы, которые препятствуют доступу субстрата к активному центру. Удаление этой блокирующей группы протеолитическими ферментами приводит к необратимой активации зимогена. Трипсиноген  Эндопептидаза расщепляет пептидную связь между лиз в положении 6 и лей в положении 7, в результате отщепляется пептид и образуется активный трипсин. Схема активации зимогена: 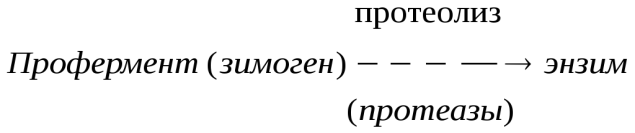 По такой схеме происходит активация целого ряда зимогенов: Пищеварительные ферменты Ферменты свертывания крови Белковые гормоны Кининовая система, компонент Фибриллярный белок проколлоген Основная черта активации зимогенов заключается в каскадном (последовательном) включении зимогенов с образованием активных ферментов например 12-перстной кишки. Регуляция путем химической модификации. По существу это изменение химической структуры активного центра. В некоторых случаях фермент может существовать в клетке в неактивной форме или слабоактивном состоянии, но присоединение фосфатной группы при участии фосфорилирующего фермента, называемого киназой, к аминокислоте вблизи от активного центра, активирует фермент. Такая система может быть возвращена в исходное состояние под действием фермента, отщепляющего фосфатную группу. Киназа Ф F F( Фосфотаза – Ф Такой механизм очень важен, т.к. активность киназы и фосфатазы могут изменяться под действием гормонов. | ||||||||||||||||||||||||