Гравиметрический анализ
 Скачать 3.29 Mb. Скачать 3.29 Mb.
|
|
Гравиметрический анализ Гравиметрический анализ основан на измерении массы вещества известного состава, химически связанного с определяемым компонентом (аналитом). Обычно определяемый компонент вступает в химическую реакцию с реагентом, называемым осадителем. Образующийся при этом малорастворимый продукт реакции (осаждаемая форма) переносят из раствора на фильтр, промывают, высушивают или прокаливают, после чего взвешивают осадок известного химического состава (взвешиваемая форма). Гравиметрическое определение строится на основании следующих стадий. Подготовка раствора – отделение мешающих компонентов и создание условий. Осаждение – создание условий низкой растворимости осадка: осаждение проводят из горячих растворов, раствор осадителя добавляют медленно при перемешивании. В первый момент образуются чрезвычайно мелкие зародышевые кристаллы, которые не могут еще выпасть в осадок, в дальнейшем кристаллы укрупняются. Если выпадение преимущественно идет на поверхности зародышей кристаллов и последние постепенно растут, то возникает кристаллический осадок. Если же зародышевые кристаллы соединяются в более крупные агрегаты и оседают на дно, то образуется аморфный осадок. Старение осадка – процесс перекристаллизации, оседание мелких кристаллов на крупных. Поскольку осадок может захватывать из раствора частицы посторонних веществ, то может происходить соосаждение, что приводит к загрязнению осадка. Вследствие перекристаллизации осадок становится чище. Промывание и фильтрование. В гравиметрии использую бумажные фильтры разной плотности. Фильтры быстрой фильтрации имеют маркировку черная лента; средней – белая, желтая и красная; медленной – зеленая и синяя лента. Фильтры «синяя лента» применяют для фильтрования мелкодисперсных кристаллических осадков (BaSO4, PbSO4, ZnS, NiS). Высушивание или прокаливание. Взвешивание на аналитических весах с точностью ±0,0001 г. Расчет содержания аналита производится следующим образом:
гдеm (X) — масса аналита, г; m (XnAm) — масса формы взвешивания, г; M (X) — молярная масса аналита, г/моль; M (XnAm) — молярная масса формы взвешивания, г/моль.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

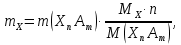
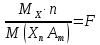 , называется гравиметрическим фактором.
, называется гравиметрическим фактором.