Химический эквивалент Эквивалент
 Скачать 45 Kb. Скачать 45 Kb.
|
|
Химический эквивалент Эквивалент(Э) – это реальная или условная частица вещества, способная соединить или заместить один моль ионов водорода в реакциях присоединения и замещения или ионообменных реакциях или принять (отдать) один моль электронов в окислительно-восстановительных реакциях. Эквивалент – безразмерная величина, состав которой выражают с помощью химических формул и символов. Моль эквивалентов – количество вещества, содержащего 6,021023 эквивалентов. Массу одного моля эквивалентов называют молярной массой эквивалентов вещества (Мэ). Единица измерения – г/моль. Молярная масса эквивалентов рассчитывается по формуле где – Z эквивалентное число. При определении числа эквивалентов вещества необходимо исходить из конкретной реакции, в которой участвует данное вещество. Например, из уравнения реакции3NaOH + H3PO4 = Na3PO4 + 3H2O следует, что одному иону водорода соответствует одна молекула NaOH, одна молекула Н2О, 1/3 молекулы Н3РО4 и 1/3 молекулы Na3РО4. Следовательно, Мэ(NaOH) = М(NaOH) = 40 г/моль; Мэ(Н3РО4) = 1/3 М(Н3РО4) = 32,67г/моль; Мэ(Na3PO4) = 1/3 M(Na3PO4) = 54,67 г/моль. Число, обозначающее, какая доля от реальной частицы эквивалентна одному иону водорода или одному электрону, называют фактором эквивалентности (fэ). В рассмотренном примере fэ(NaOH) = 1, fэ(Н3РО4) = fэ(Na3РО4) = 1/3. Для окислительно-восстановительных реакций используют понятие «эквивалентное число» (Z), которое равно числу электронов, присоединенных одной молекулой окислителя или отданных одной молекуле восстановителя. Для расчета молярной массы эквивалентов вещества используют следующие формулы: где х – число атомов металла или неметалла; z – основность кислоты или кислотность основания, соответствующие кислотному или основному оксиду. В – валентность металла. Для вычисления объема моля эквивалентов (Vэ)газов необходимо знать число молей эквивалентов в одном моле газа. Так, Мэ(Н2) = 1 г/моль, что в два раза меньше массы моля, следовательно, объем моля эквивалентов водорода в два раза меньше объема моля (при н.у.) и составит Vэ(Н2) = Vm : 2 = 11,2 л. Аналогично, МэК(О2) = ¼ М(О2) = 32 : 4 = 8 г/моль, отсюда объем одного моля эквивалентов кислорода в четыре раза меньше его молярного объема и составляет 5,6 л. Суть закона эквивалентов заключается в том, что вещества взаимодействуют друг с другом в эквивалентных соотношениях: 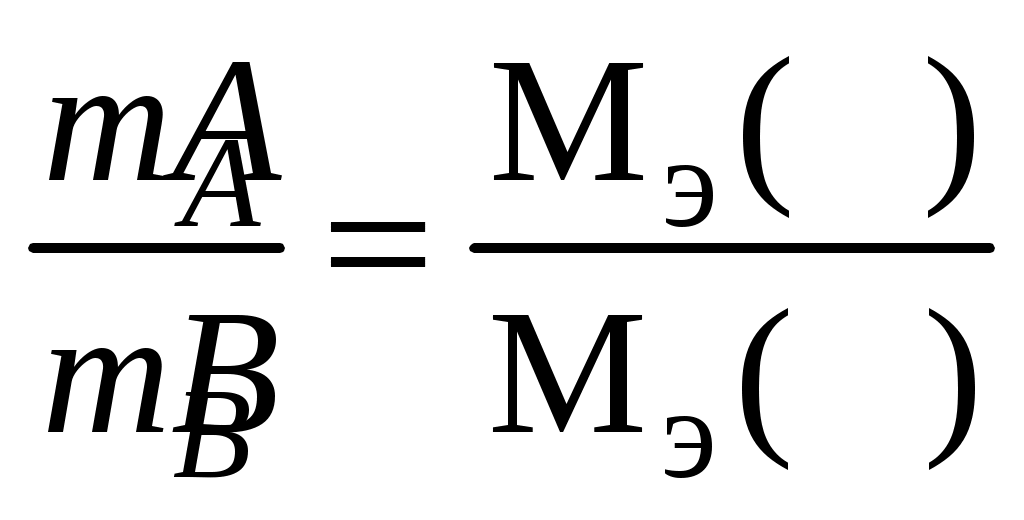 . .Для реагирующих веществ, находящихся в растворе, закон эквивалентов удобно представить в виде Сэ(А)V(A) = Cэ(В)V(В), где Сэ(А)и Сэ(В) – молярные концентрации эквивалентов растворов А и В, моль/л; V(A)иV(B) – объемы реагирующих веществ, л. |
