Газ заңдары. Идеал газ кйі тедеуіні кмегімен газ массасы ж не ш параметрді ысым, клем немесе температура
 Скачать 85.5 Kb. Скачать 85.5 Kb.
|
|
ГАЗ ЗАҢДАРЫ Идеал газ күйі теңдеуінің көмегімен газ массасы және үш параметрдің — қысым, көлем немесе температура — біреуі өзгермей қалған жағдайдағы процестерді зерттеуге болады. Газдың бір параметрінің1 мәні тағайындалып, қалған ек1 мәні арасындағы сандық, тәуелділікті айқындайтын заңдарды газ заңдары деп атайды. Параметрлердің біреуінің мәні өзгермей қалған кезде өтетін процестер изопроцестер деп аталады. Изопроцестер табиғатта кең таралған және техникада жиі пайдаланылады. Шынында да, ешбір процесс қандай да болмасын қатаң тағайындалған бір параметрдің мәнінде жүрмейді. Температураның, қысымның, немесе көлемнің тұрақтылығын бұзуға әсер ететін қандай да бір жағдайлар болады. Тек лабораториялық жағдайларда ғана кайсыбір параметрлердің тұрақтылығын тым дәлірек сақтағга болады, бірак жұмыс істейтін техникалық кұрылғылар-да және табиғатта бұл іс жүзінде әсте мүмкін емес. Изопроцесс — бұл нақты процестің идеалдандырылған моделі. Ол шындықты тек жуық қана бейнелейді. Изотермиялық процесс. Температура тұрақты болғанда мак-роскопиялық, денелердің термодинамикалық, жуйесі күйінің өзгеру процесін изотермиялық, деп атайды. Газ температурасын тұрақты етіп ұстау ушін ол температурасы тұрақты болып тұратын үлкен жүйемен — термостатпен — жылу алмасатындай болуы қажет. Өйткені сығылғанда немесе ұлғайғанда газдың, температурасы өзгеретін болады, Егер атмосфералық ауаның, температурасы бүкіл процесс барысында елеулі өзгермесе, онда ол термостат қызыметін атқара алады. Идеал газ күйінің теңдеуіне pV= pV=const. Егер газдың температурасы өзгермесе, онда оның берілген массасы ушін газ қысымының көлемге көбейтіндісі тұрақты болады. Бұл заңды тәжірибе жүзінде ағылшын ғалымы Р. Бойль (1627—1691), одан біраз кейінірек француз ғалымы Э. Мариотт (1620—1684) ашты. Сондықтан ол Бойль — Мариотт заңы деп аталады. Бойль — Мариотт заңы кез келген газ ушін, сондай-ақ олардың қоспасы үшін де, мысалы, ауа ушін де дұрыс. Тек атмосфералық қысымнан бірнеше жүз есе жоғары қысымдарда ғана бұл заңнан ауытқу елеулі түрде байқалады. Атмосфералыққа жақын қысымдарда Бойль — Мариотт заңының дұрыстығына алдыңғы параграфта сипатталған қондырғының көмегімен көз жеткізуге болады. Тұрақты температурада газ қысымының көлемге тәуелділігі график түрінде изотерма деп аталатын қисық сызық арқылы кескінделеді. Газдың изотермасы қысым мен көлемнің арасындағы кері пропорционал тәуелділкті өернектейді. Қйсык сызықтың мұндай түрін математикада гипербола деп атайды (1-сурет) Әр түрлі тұрақты температураға әр түрлі изотермалар сәйкес келеді. Егер V=const болса, температура жоғарылағанда қысым күй теңдеуіне pV= Компрессормен ауаны сығу процесін немесе ыдыстары ауаны сорып шығарғанда поршень астындағы ауаның ұлғаюын — шамамен изотермиялық процесс деп есептеуге болады. Шынында, бұл жағдайда температура өзгеретіні рас, алайда алғашқы жуықтауда ондай өзгерісті елемеуге де болады. Изобаралық процесс. Қысым тұрақты болғанда термодинамикалық, жүйе күйінің өзгеру процессі изобаралық деп аталады. pV= P=const болғанда, Егер газ қысымы өзгермесе, берілген массалы газ ушін көлемнің температураға қатысы тұрақты болады. Бұл заңды 1802 жылы француз ғалымы Гей-Люссак (1778—1850) тәжірибе жүзінде тағайындаған және сондықтан ол Гей-Люссак заңы деп аталады. P=const болғанда, V=const. T Бұл тәуелділік график түрінде изобара деп аталатын түзумен кескінделеді (2-сурет). Әр түрлі қысымға әр түрлі изобара сәйкес келеді. Қысым артқан сайын, тұрақты температурада Бойль — Мариотт заңы бойынша газдың көлемі кішірейеді. Сондықтан жоғарырақ Р2қысымға сәйкес келетін изобара төменірек Р1қысымға сәйкес келетін изобарадан төменірек жатады. Төменгі температуралар аймағында идеал газдың барлық изобаралары Т=0 нүктесінде түйіседі. Бірақ, бұл реал (нақты) газдың көлемі шынында да нөлге айналады деуге болмайды. Барлық газдар қатты суынғанда сұйыққа айналады, ал күй тендеуі pV= Жылжымалы поршеньді цилиндрдегі газды қыздырғанда оның, ұлғаюын изобаралық процесс деуге болады. Онда цилиндрдегі қсымның тұрақтылығы поршеньнің үстіңгі бетіне атмосфералық ауа қысымының әсері арқылы жүзеге асады. 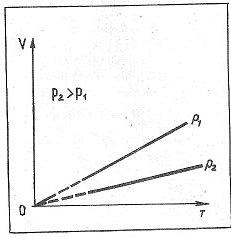  1- Сурет 2- Сурет Изохоралық процесс. Көлем тұрақты болғанда термодинамикалық жүйе күйінің өзгеру процесін изохоралық деп атайды. Күй теңдеуінен pV= pV=const болғанда, Егер газ көлемі өзгермесе массасы берілген газ ушін қысымның температураға қатысы тұрақты болады. Бұл газ заңын 1787 жылы француз физигі Ж. Шарль (1746-1823)ашқан және сондықтан ол Шарль заңы деп аталады. pV=const болғанда, температураға сызықтық тәуелді болады, яғни: p=const T. Бұл тәуелділік графикте түзумен кескінделеді де, ол изохора деп аталады (3-сурет). Түрлі көлемге түрліше изохора сәйкес келеды. Температура тұрақты болғанда, Бойль — Мариотт заңына сәйкес, газ көлемі ұлғайғанда оның қысымы азаяды. Сондықтан ұлкен V2көлемге сәйкес келетін изохора, кіші V1көлемге сәйкес келетін изохорадан төмен жатады. p=const T тендеуге сәйкес барлық изохоралар Т = 0 нүктесінен басталады. Демек, абсолют нөлде идеал газдың қысымы нөлге тең. Кез келген жабық ыдыстағы немесе электр шамындағы газды қыздырғандағы газ қысымының ұлғаюы изохоралық процесс болып табылады. Изохоралық процесс көлемі тұрақты газ термометрлерінде пайдаланылады. 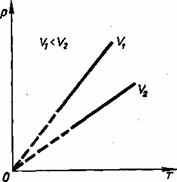 3- Сурет |
