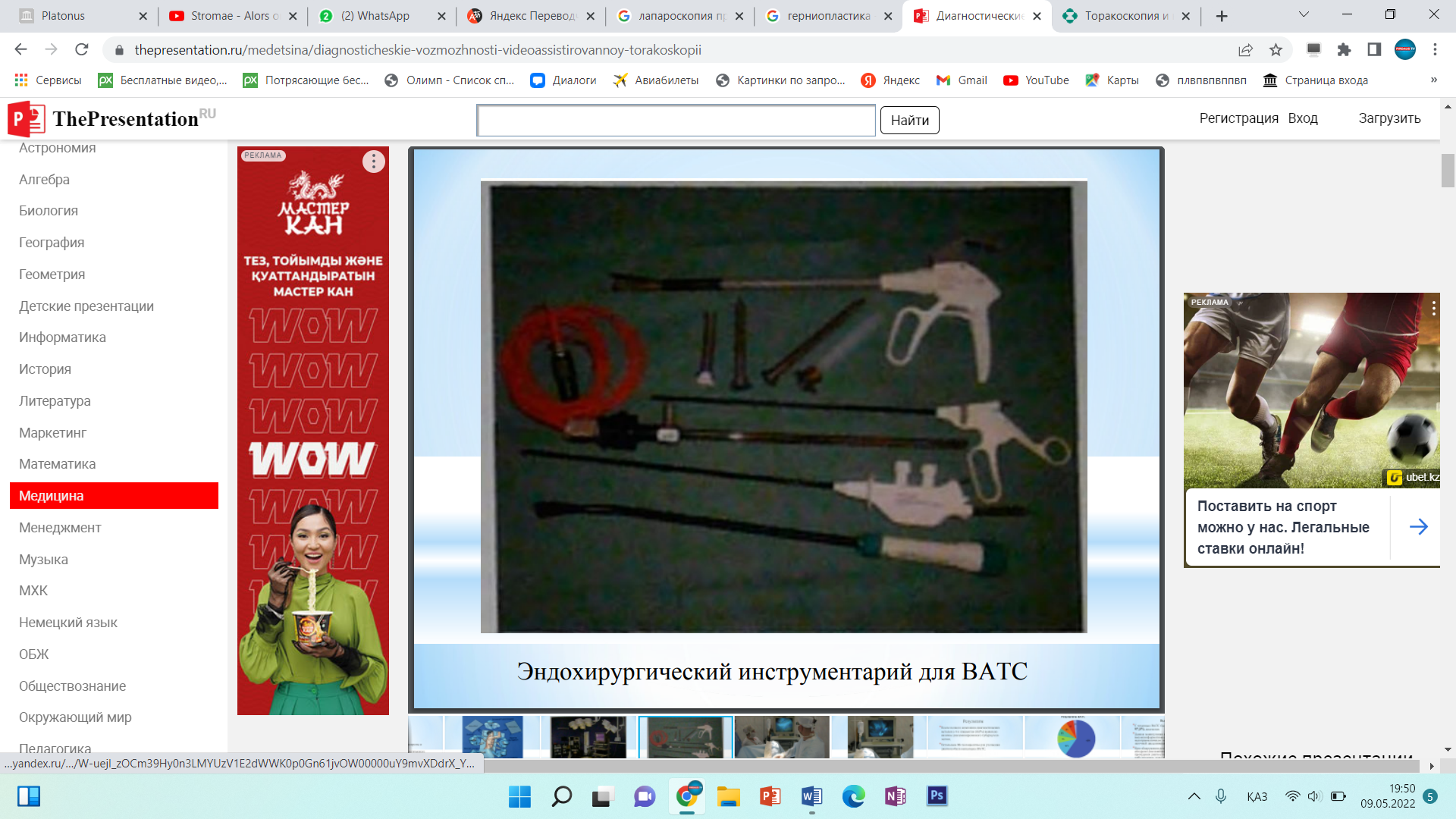
Хирургия ответы. Экз Хирургия. Инструменты для лапароскопической классической холецистэктомии
 Скачать 7.19 Mb. Скачать 7.19 Mb.
|
|
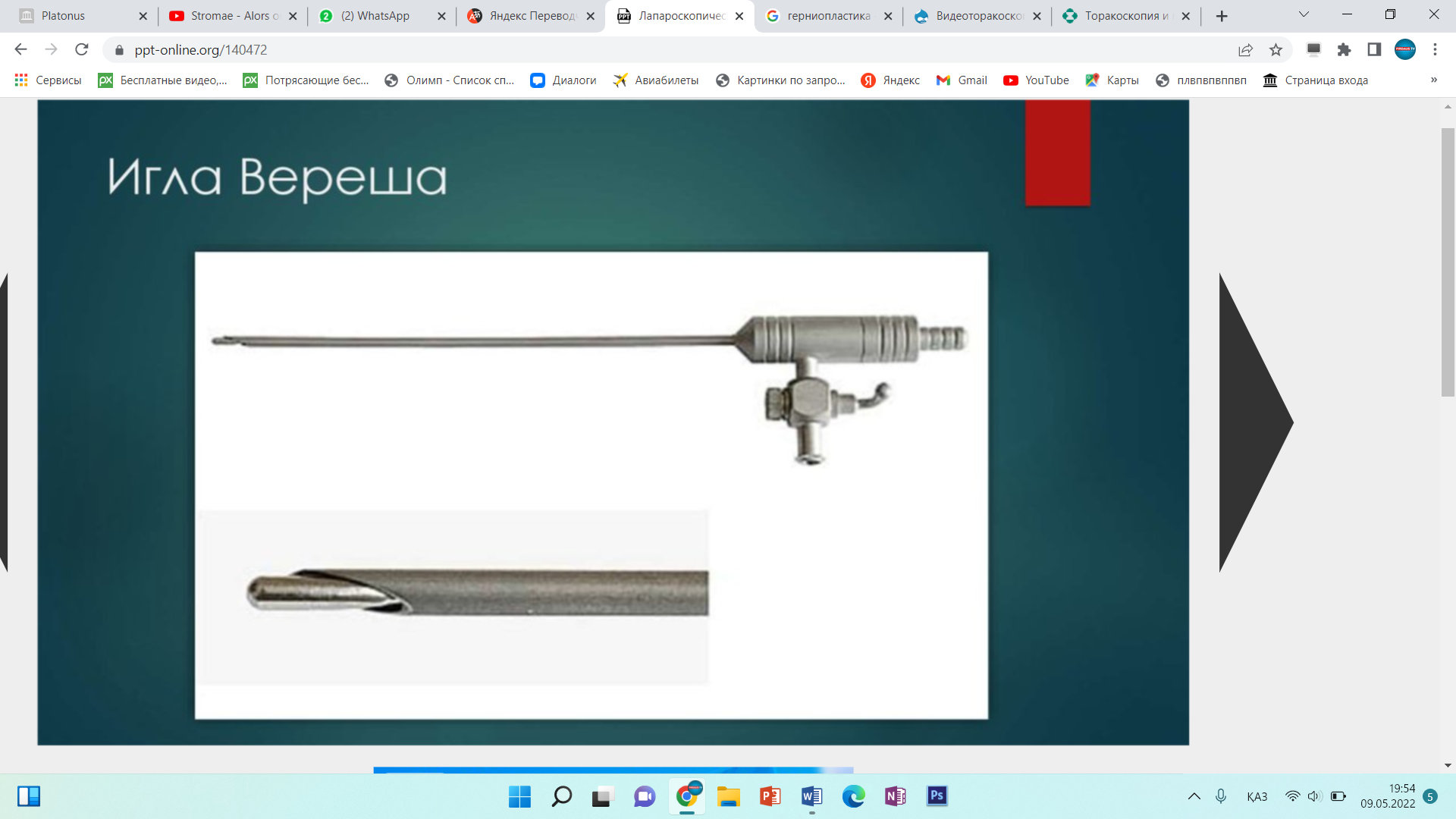
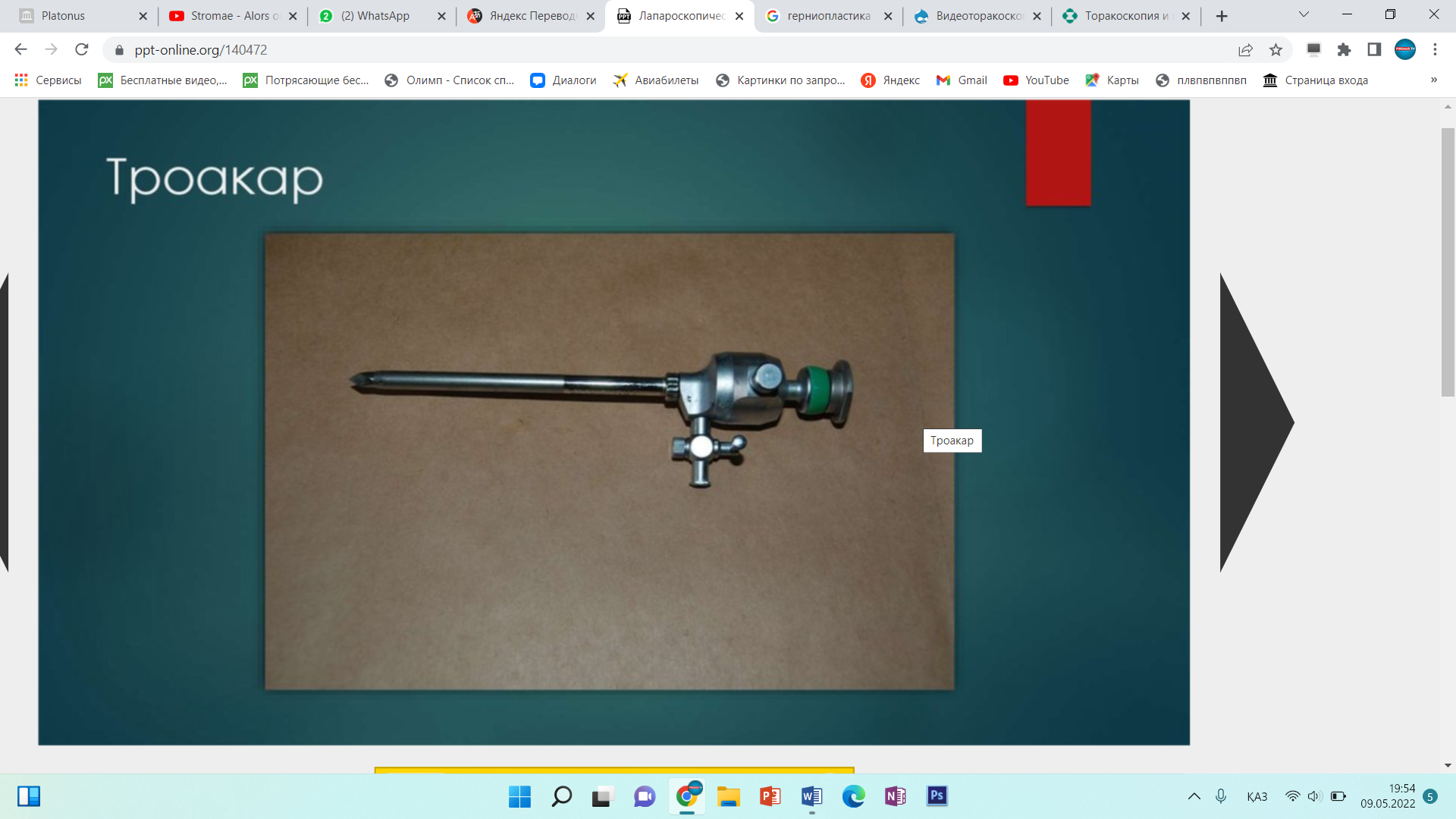
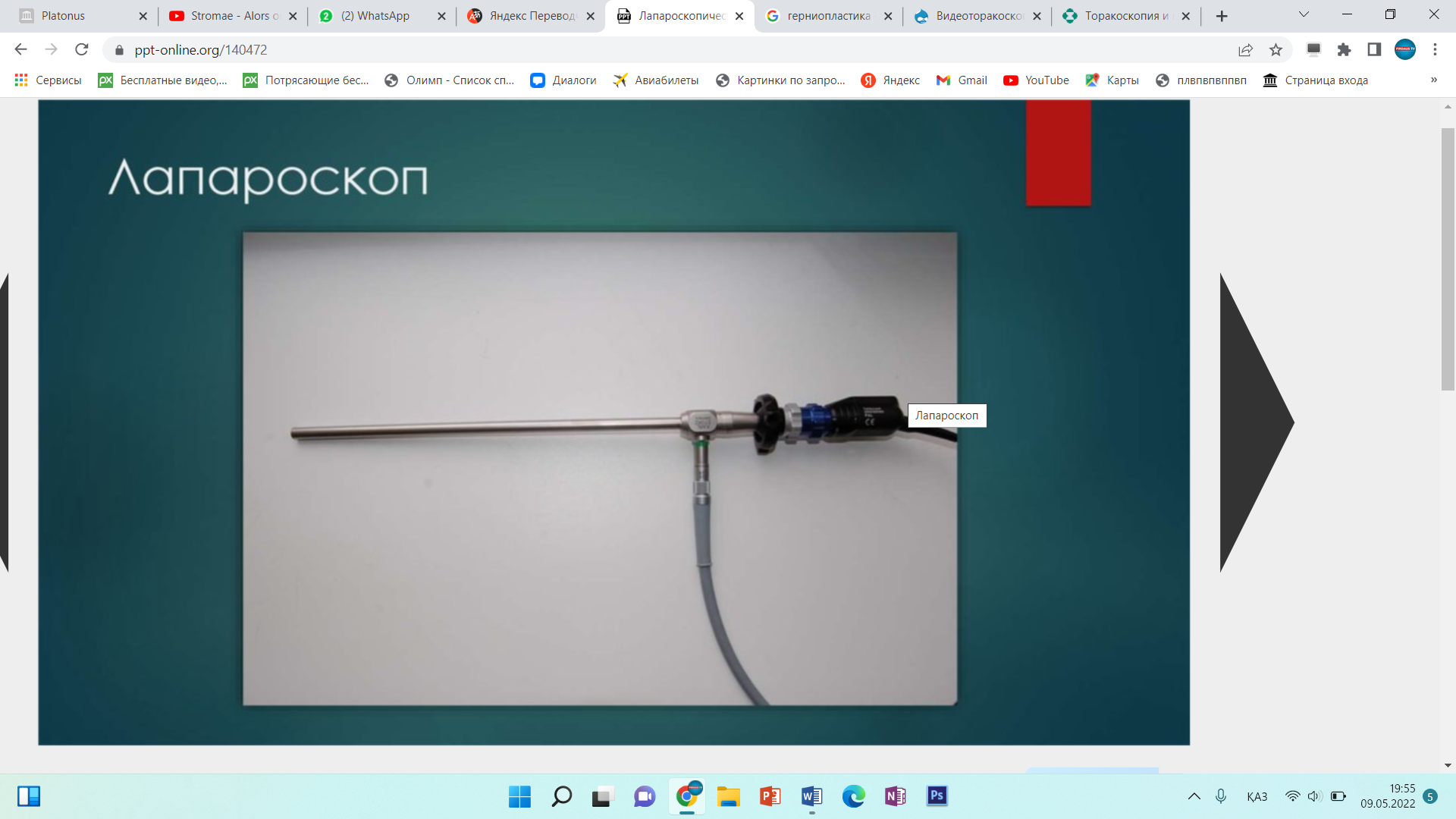
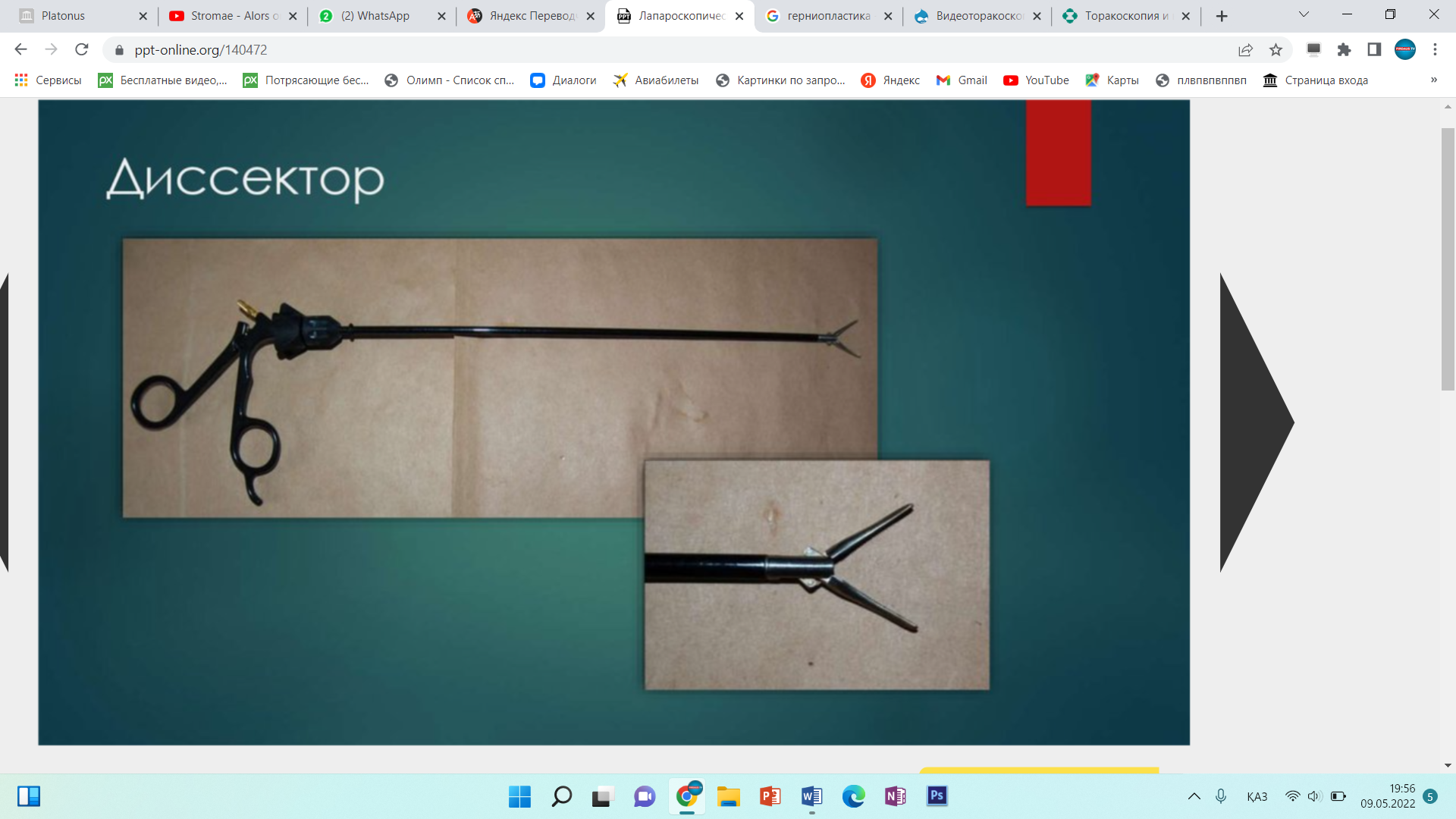
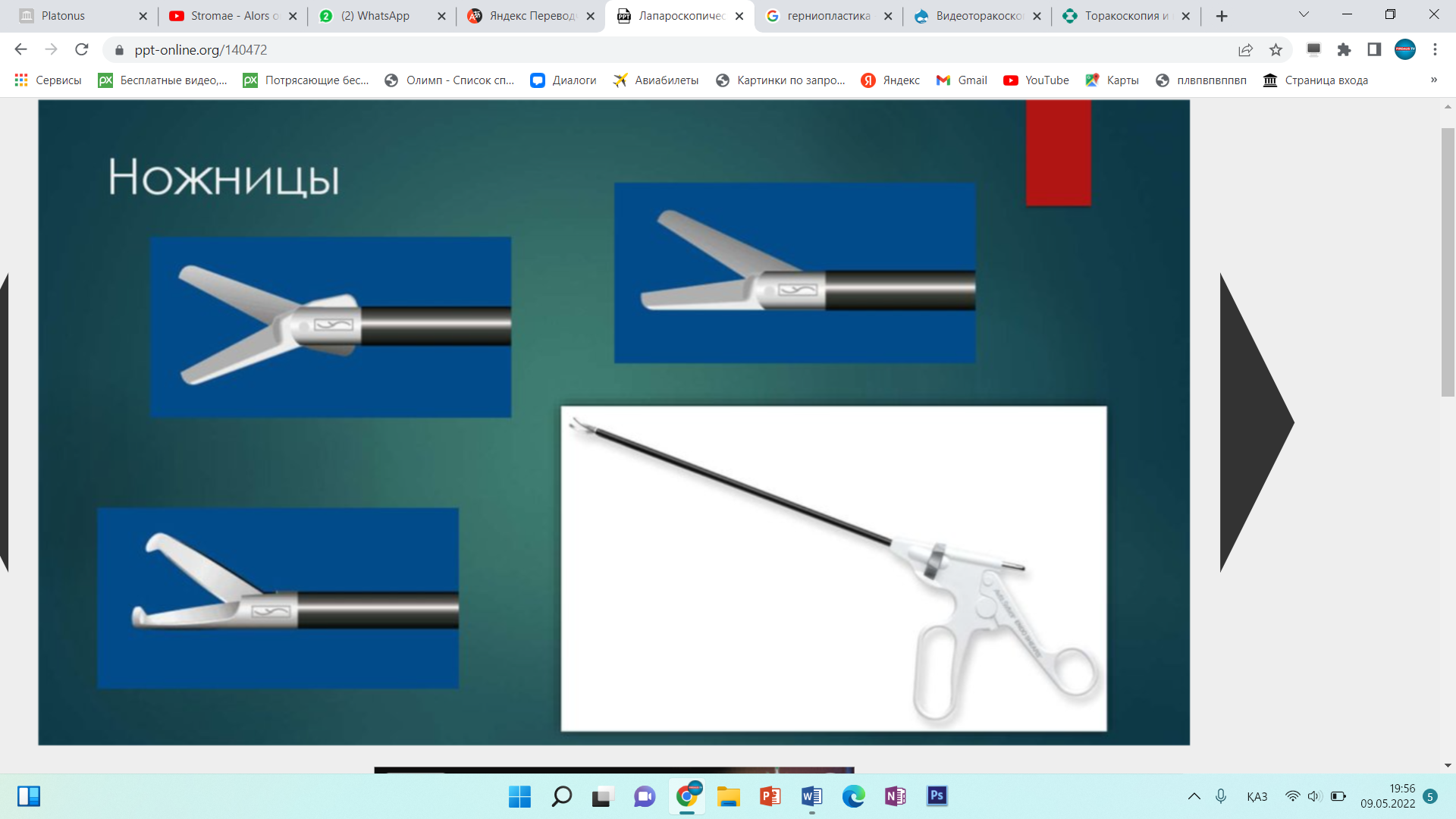
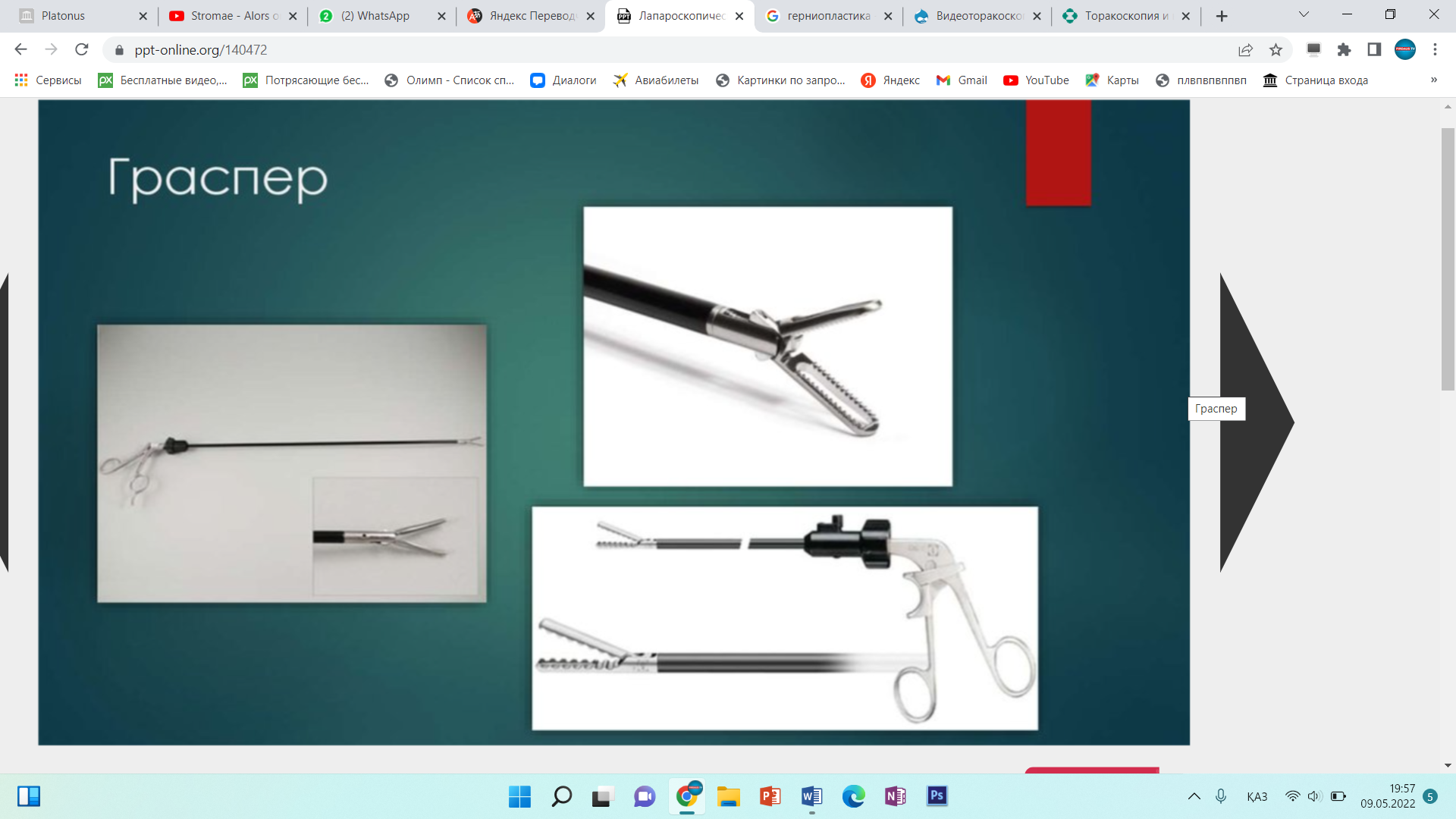
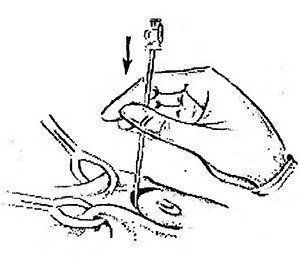
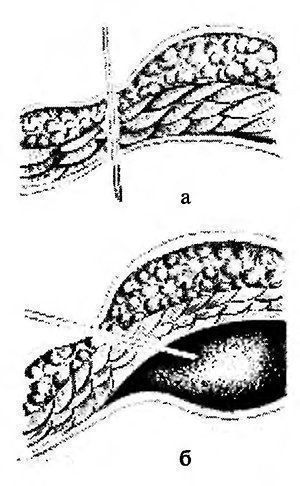
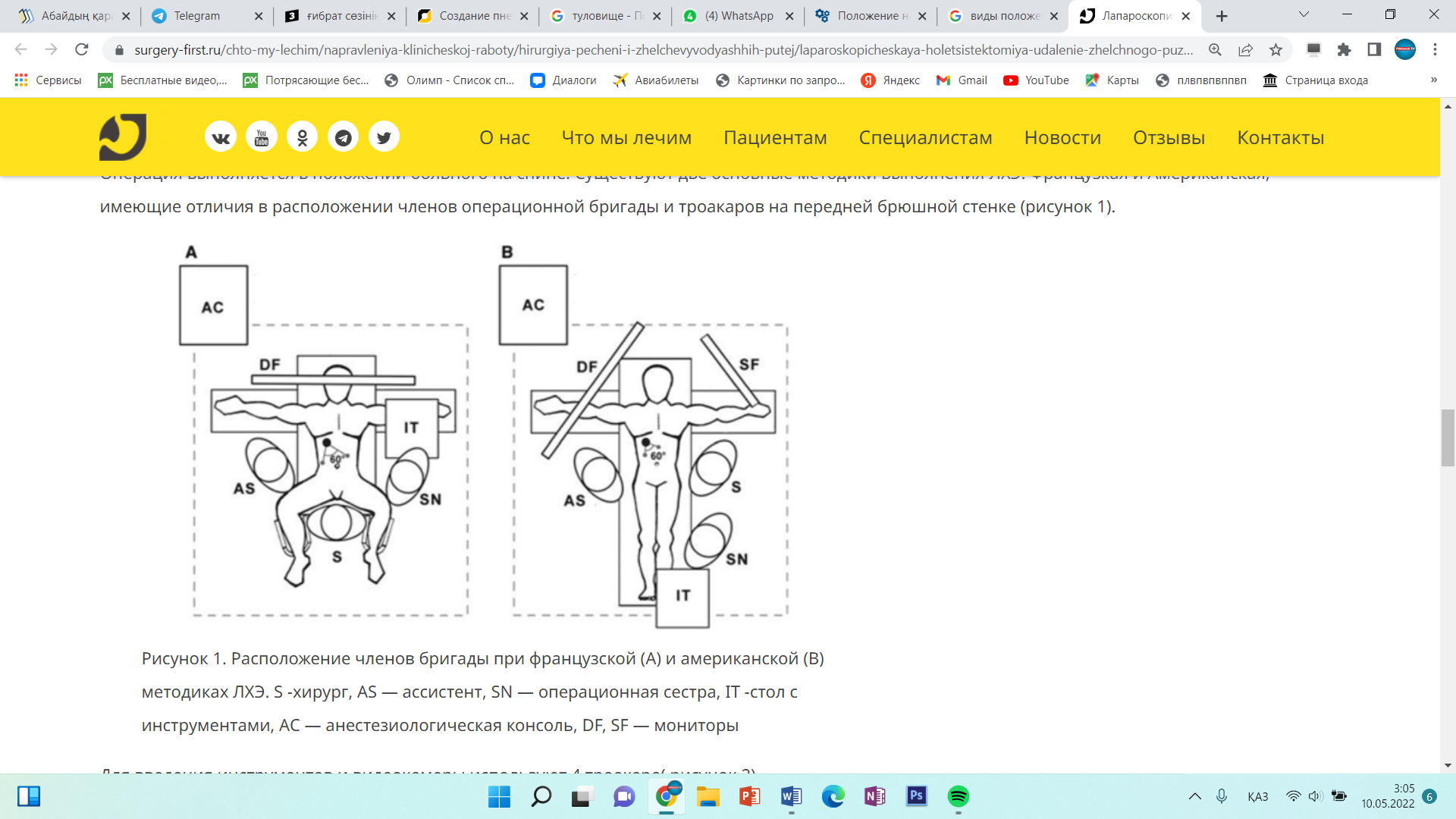
Инструменты для лапароскопической классической холецистэктомии лапароскопический комплекс (видеокамера, осветитель, инсуфлятор, коагулятор, видеомонитор) – 2 шт; аппарат дозированной биполярной коагуляции «LigaSure» – 1 шт; аппарат «ультразвуковой скальпель» -1 шт; лапароскоп диаметром 10 мм– с торцевым срезом 30гр световолоконный кабель Амортизация лапароскопического комплекса ( позиции 1-5) игла Вереша– 1 150 руб. игла Эндоклоуз – 2 200 руб. троакары диаметром 5 мм – 2 шт. – 7 000 руб. троакары диаметром 11 мм – 2 шт. – 4 000 руб. = 8 000 руб. эндоскопический атравматический зажим мягкий 5мм – 1 шт. – 7 000 руб. эндоскопический когтистый зажим 5 мм – 1 шт. – 7 000 руб. эндоскопический диссектор 5 мм – 1 шт. – 7 000 руб. эндоскопические ножницы 5 мм – 1 шт. – 7 000 руб. монополярны L– электрод – 3 300 руб. канюля для аспирации/ирригации диаметром 5 мм – 8 000 руб. эндопуш (для формирования экстракорпорального шва)– 1 650 руб. шовный материал полисорб 3/0 на атравматичной круглой игле – 8 шт. – 200 р * 8 = 1 600 руб. противоспаечный гель (барьер) – 1 упаковка 200 мл – 3 000 руб. пластиковый контейнер – шт. – 7 600 руб. пластина монополярного электрода двойная (защита ожога)– 500 руб. монополярный шнур – 1 000 руб. одноразовая система управляемой дозированной компрессии нижних конечностей (Kendal, Швейцария) – 1 шт. – 2 997 руб. одноразовая система обогрева пациента во время оперативного вмешательства (Kendal, Швейцария) – 1 шт. – 1 100 руб. трансназальный зонд – 1 шт. – 246 руб. уретральный катетер с мерным мешком – 1 шт. – 373 руб. венозный порт – 1 шт. – 69 руб. эндотрахеальная трубка – 1 шт. 72 руб. гемостатик 1 упаковка. Лапароскопическая аппендэктомия включает следующие этапы: 1. тракция червеобразного отростка; 2. пересечение брыжейки; 3. обработка культи червеобразного отростка; 22 4. извлечение червеобразного отростка; 5. контрольная ревизия, санация, дренирование (по показаниям) брюшной полости; 6. завершение операции. При выполнении лапароскопической аппендэктомии ретроградным способом очередность 2 и 3 этапов изменяется. Техника проведения 2.3. Расположение пациента, персонала и оборудования Пациент лежит на спине со сведенными ногами в положении Тренделенбурга с наклоном операционного стола в левую сторону, что 15 позволяет отвести большой сальник и петли тонкого кишечника от правой подвздошной ямки. Для более тщательной ревизии брюшной полости и ее санации в процессе операции часто возникает необходимость в изменении положения операционного стола. Операция выполняется бригадой в составе трех человек: оператора, ассистента и операционной сестры. Оператор находится слева от пациента и работает обеими руками. Ассистент манипулирует видеокамерой и может находиться как справа, так и слева от пациента. Операционная сестра с инструментальным столиком располагается слева от пациента около ножного конца операционного стола. Эндовидеохирургический комплекс с монитором располагают справа от пациента около ножного конца операционного стола. 2.6.1. Тракция червеобразного отростка Аппендикс захватывают эндоскопическим зажимом в области дистального конца или за край брыжейки и приподнимают по направлению к передней брюшной стенке. При фиксации отростка спайками, последние рассекают эндоскопическими ножницами. Рыхлый инфильтрат разделяют наконечником аспиратора-ирригатора для быстрой аспирации гноя в случае опорожнения периаппендикулярного абсцесса. К. Франтзайдес [36] для тракции отростка предлагает использовать лигатуру с эндопетлей, затянутую в области верхушки отростка. С нашей точки зрения данный способ тракции, не имея ощутимых преимуществ во время операции, увеличивает продолжительность и себестоимость лапароскопической аппендэктомии. 2.6.2. Пересечение брыжейки червеобразного отростка В зависимости от анатомических особенностей брыжейки, степени выраженности в ней воспалительных изменений, технической оснащенности операционной оператор может выбрать следующие способы обработки брыжейки червеобразного отростка: − электрокоагуляция; − лигирование; − клипирование; − аппаратный способ пересечения. По данным литературы отечественные хирурги чаще используют электрокоагуляцию в биполярном режиме, как наиболее простой и безопасный 23 способ обработки брыжейки червеобразного отростка [4, 7, 28, 35]. Пересечение начинают со свободного края брыжейки. Ткань брыжейки захватывают биполярными щипцами по 2−3 мм и коагулируют до приобретения тканью белого цвета. Затем на место биполярного инструмента устанавливают эндоскопические ножницы и коагулированную порцию брыжейки отсекают. Поочередно работая биполярными щипцами и ножницами, «шаг за шагом» продвигаются до основания отростка. Допустима коагуляция брыжейки и в монополярном режиме с помощью эндоскопического диссектора. Однако, при использовании монополярной электрокоагуляции необходимо постоянно помнить о реальной опасности электрохирургического повреждения кишечника в результате как прямого, так и емкостного пробоя электрического тока. Необходимо отметить, что ряд авторов сообщают о возникновении абсцессов в области коагуляционного струпа брыжейки (в 6,7% случаев) и считают недопустимым использование электрокоагуляции значительного массива ткани при наличии очага гнойного воспаления [2, 14, 50, 66]. Лигирование брыжейки можно выполнять при длине последней не менее 3 см. Шовный материал, используемый для лигирования, должен рассасываться в сроки 2−3 месяца, хорошо держать узел, незначительно терять прочность в узле [9]. Этим требованиям наиболее полно отвечают нити “Polysorb” (фирма Auto Suture) и “Vicril” (фирма Ethicon). Недопустимо использовать монофиламентные нити, так как они плохо держат узел и при захватывании и удержании эндоскопическими инструментами могут потерять прочность и затем порваться. Наиболее часто используется нить с условным диаметром 0. Длина нити при формировании экстракорпорального узла должна быть не менее 60 см, при формировании интракорпорального узла – 10−15 см. Эндоскопическим диссектором перфорируют брыжейку червеобразного отростка на расстоянии 2 см от ее края. Затем диссектором захватывают конец лигатуры и протягивают его в окно брыжейки с последующим формированием экстракорпорального или интракорпорального узла. Экстракорпоральная 24 методика формирования узла считается технически более простой, однако, требует гораздо большего количества шовного материала. При необходимости все этапы повторяют до полной мобилизации брыжейки. Необходимо помнить, что попытки лигирования порций шириной более 2 см, особенно при вовлечении брыжейки в воспалительный процесс, могут привести к соскальзыванию лигатуры с кровотечением, как во время операции, так и в послеоперационном периоде. Для профилактики соскальзывания лигатуры, особенно при работе на отечной, инфильтрированной брыжейке, лигирование рекомендуется дополнить прошиванием последней. Клипирование сосудов показано при короткой брыжейке, вовлеченной в воспалительный процесс, а так же при ретроцекальном и забрюшинном расположении отростка. С помощью эндоскопических ножниц осторожно рассекают брюшину брыжейки, диссектором скелетируют аппендикулярные сосуды. Сосуд клипируют одной или двумя титановыми клипсами и пересекают эндоскопическими ножницами. Наиболее часто используются клипсы средне-большого размера. Необходимо помнить о том, что недопустимо использовать монополярную электрокоагуляцию брыжейки после наложения клипс. Не оправдано клипирование сосудов вслепую в толще отечных тканей брыжейки – такие манипуляции могут привести к соскальзыванию клипсы после уменьшения отека тканей, кроме того, значительно увеличивается расход клипс и себестоимость операции. Аппаратный способ пересечения брыжейки на сегодняшний день считается самым быстрым, надежным и технически наиболее простым [4, 28, 35]. Принцип аппаратного скобочного шва – это применение П-образных титановых скобок, которые после прошивания тканей упираются в металлическую матрицу и сгибаются в В-образную форму, прочно и надежно соединяя ткани. В эндоскопической хирургии широкое распространение получил аппарат ENDO GIA (фирма Auto Suture) диаметром 12 мм. Аппарат накладывает 6 рядов титановых скрепок в шахматном порядке, одновременно рассекая ткань между 3 и 4 рядом скрепок. Линейный степлер ENDO GIA 30 25 комплектуется тремя типами одноразовых сменных кассет, предназначенных для прошивания тканей различной толщины: − серая кассета с высотой незакрытой скрепки 2 мм предназначена для прошивания сосудов; − белая кассета с высотой незакрытой скрепки 2,5 мм предназначена для прошивания тонкой ткани; − синяя кассета с высотой незакрытой скрепки 3,5 мм предназначена для прошивания тканей нормальной толщины: кишка, желудок. При использовании степлера в брыжейке около основания червеобразного отростка диссектором формируется окно. Затем бранша аппарата проводится через сформированное окно, брыжейка прошивается и одновременно пересекается. Тонкую брыжейку, не вовлеченную в воспалительный процесс, прошивают белой кассетой, а отечную и инфильтрированную брыжейку лучше прошить синей кассетой. К недостаткам описанного способа обработки брыжейки относят высокую стоимость сменных кассет (до 130 $), а также невозможность применения степлеров при короткой брыжейке, ретроцекальном и забрюшинном расположении отростка. Исходя из соображений экономической целесообразности, аппаратный способ обработки брыжейки червеобразного отростка оправдан только при обоснованной необходимости сократить время операции, например, при тяжелой сопутствующей патологии или беременности. В последнее время появилось много публикации об успешном использовании ультразвуковых ножниц, радиохирургических приборов, высокомощных полупроводниковых лазеров для пересечения брыжейки [3, 10, 11, 46]. К преимуществам этих приборов авторы относят отсутствие опасности электрохирургических осложнений, возможность работать в непосредственной близости от титановых клипс и скрепок, минимальная термическая и механическая травматизация тканей, выраженный бактерицидный эффект (особенно при воздействии лазером). К недостаткам методик можно отнести высокую стоимость оборудования и инструментов. 26 В заключение необходимо сказать, что универсальных способов обработки брыжейки на сегодняшний день не существует. Подход к выбору способа обработки брыжейки червеобразного отростка должен быть строго индивидуальным. Необходимо помнить также о возможности сочетанного использования нескольких способов обработки брыжейки. 2.6.3. Обработка культи червеобразного отростка В зависимости от анатомических особенностей аппендикса, степени выраженности в области его основания воспалительных изменений, опыта хирургической бригады, технической оснащенности операционной оператор может использовать следующие способы обработки культи червеобразного отростка: − лигатурный; − погружной; − аппаратный. Лигатурный способ применяется наиболее часто в эндоскопической хирургии, так как является наиболее простым, легко выполнимым и достаточно надежным [4, 20, 28, 35]. Еще в 1961 году А.И. Ленюшкин [21] в эксперименте убедительно доказал, что культя червеобразного отростка при лигатурном методе аппендэктомии постепенно самостоятельно погружается в слепую кишку. Автор опроверг утверждение о неминуемом усиленном образовании спаек после лигатурного метода обработки культи аппендикса. На сегодняшний день сотнями тысяч эндоскопических и открытых операций доказана безопасность этого способа [7]. Однако, необходимо отметить, что некоторые хирурги [22] не разделяют эту точку зрения, считая, что при использовании лигатурного способа нередко возникают инфильтраты в области непогруженной культи аппендикса. Поэтому авторы используют только погружные способы при выполнении лапароскопической аппендэктомии. Лигирование основания червеобразного отростка можно выполнить с использованием как экстракорпорального, так и интракорпорального узла. 27 Большинство хирургов предпочитают использовать экстракорпоральный узел, так как интракорпоральный способ формирования узла считается технически более сложным и требует введения дополнительного четвертого троакара. Требования к шовному материалу подробно описаны на странице 23. Существует несколько способов формирования экстракорпорального узла. Мы при лигировании червеобразного отростка наиболее часто используем узел, представленный на рис. 6, 7. Рис. 6. Схема формирования экстракорпорального эндоузла и петли Рис. 7. Узел сформирован и смещается дистально, петля затягивается Для удобного наложения петли на отросток целесообразно сначала провести в петлю зажим, а затем, захватив зажимом верхушку отростка, опустить петлю на его основание. Для большей надежности на культю червеобразного отростка лучше наложить две лигатуры на расстоянии 2−4 мм друг от друга. Некоторые авторы для герметизации культи отростка вместо лигатуры используют клипсы [1, 11, 13, 35]. По нашему мнению клипирование основания аппендикса весьма опасно, так как конструктивные особенности клипаппликатора и клипсы не позволяют дозировать степень сжатия последней в зависимости от толщины тканей, что может привести к соскальзыванию клипсы или пересечению клипсой основания отростка. На дистальный отдел аппендикса можно 28 наложить лигатуру, клипсу или зажим. Однако, необходимо помнить, что герметизация аппендикса клипсой или зажимом весьма ненадежна, во время извлечения препарата клипса или зажим часто соскальзывают и содержимое аппендикса попадает в рану или брюшную полость с инфицированием последних. Между лигатурами отросток пересекают эндоскопическими ножницами с таким расчетом, чтобы длина культи над лигатурой была не менее 2 мм, но не более 4 мм. Техника лигатурного способа обработки культи червеобразного отростка предусматривает обязательное удаление слизистой оболочки с культи и антибактериальную обработку последней. Большинство отечественных авторов для удаления слизистой оболочки используют монополярную электрокоагуляцию, указывая при этом, что данный этап операции самый опасный в отношении электрохирургических осложнений [4, 35, 28]. Дело в том, что согласно законам физики наибольшая плотность тока, а, следовательно, и максимальное выделение тепловой энергии наблюдается в участке электрической цепи с наименьшим диаметром проводника. Во время электрокоагуляции слизистой оболочки культи аппендикса в электрической цепи возникают два участка с малым диаметром проводника. Первый в области контакта электрода со слизистой оболочкой (область желаемого электрохирургического воздействия), второй – у основания червеобразного отростка в области наложенных ранее лигатур. Выделение тепловой энергии в области наложенных лигатур может привести к соскальзыванию последних и ожогу купола слепой кишки с последующей несостоятельностью культи червеобразного отростка. Для профилактики осложнений во время электрокоагуляции слизистой оболочки культи аппендикса необходимо соблюдать следующие правила: − на электрохирургическом генераторе устанавливают минимальную мощность, обеспечивающую необходимое воздействие; − площадь контакта электрода со слизистой должна быть минимальной (необходимо использовать электрод-иглу или электрод-крючок); 29 − во время электрохирургического воздействия необходимо постоянно следить за местом наложения лигатур и куполом слепой кишки и при появлении первых признаков термического воздействия (изменение цвета, усадка тканей) немедленно прекратить электрохирургическое воздействие; − недопустима электрокоагуляция слизистой оболочки культи при клипировании основания червеобразного отростка. В литературе описана электрокоагуляция основания аппендикса в биполярном режиме с последующим лигированием и отсечением отростка [25]. Преимуществом биполярной коагуляции является отсутствие электрического потока в окружающих тканях, что исключает нежелательные электротермические эффекты вне зоны операции. Однако, биполярный электрохирургический инструмент не позволяет произвести прицельную коагуляцию только слизистой оболочки, нежелательному термическому воздействию подвергаются все ткани культи червеобразного отростка, что может привести к некрозу и несостоятельности последней [15]. Проведенный нами анализ результатов бактериологических посевов с культи червеобразного отростка до и после электрохирургического воздействия показал, что применение монополярной электрокоагуляции явно недостаточно для стерилизации культи аппендикса (до электрокоагуляции бактерии высеяны в 81,1% наблюдений, после воздействия – в 69,3% наблюдений). Аналогичные результаты были получены А.М. Махлиным, А.А. Свирским, В.И. Авериным [25], авторы использовали биполярную электрокоагуляцию для обработки культи червеобразного отростка. Поэтому, мы, как и многие другие хирурги [8, 14, 28] при использовании электрокоагуляции для обработки слизистой оболочки, дважды обрабатываем культю червеобразного отростка 5% спиртовым раствором йода или спиртовым раствором хлоргексидина до и после коагуляции. На кафедре хирургии и эндоскопии УГМАДО совместно с Челябинским государственным институтом лазерной хирургии был разработан и внедрен в 30 клиническую практику новый способ обработки культи червеобразного отростка с использованием высокоинтенсивного лазерного излучения ближнего инфракрасного диапазона (заявка на патент на изобретение Российского агентства по патентам и товарным знакам № 2004114392 от 11 мая 2004 года). В качестве источников лазерного излучения мы использовали высокомощные полупроводниковые лазеры с длиной волны излучения 805 и 970 нм. Данные лазерные приборы, по нашему мнению, наиболее полно на сегодняшний день отвечают требованиям малоинвазивной хирургии. Полупроводниковый лазер компактен, прост в работе, безопасен для больного и медперсонала. При использовании лазерного излучения во время лапароскопических операций медперсоналу нет необходимости надевать защитные очки, так как визуальный контроль за процедурой осуществляется через видеокамеру и экран монитора. Гибкий кварц-кварцевый моноволоконный световод диаметром 600 мкм позволяет легко подвести лазерное излучение к любому органу брюшной полости через лапароскопический доступ. В ходе экспериментального исследования на 30 беспородных собаках были определены оптимальные режимы воздействия лазерного излучения на культю червеобразного отростка и изучена морфологическая картина культи аппендикса после воздействия высокоинтенсивного лазерного излучения и электрокоагуляции на сроках от 1 до 30 суток. Было установлено, что наиболее оптимальным является импульсный режим, с длительностью импульса 50 мс, паузы – 50 мс, при средней мощности 4 Вт, со световодом диаметром 600 мкм, бесконтактный способ воздействия, плотность мощности излучения от 0,15 до 0,25 Вт/мм². Данный режим лазерного воздействия обеспечивал наиболее полное удаление слизистой оболочки культи аппендикса с минимальным термическим повреждением окружающих тканей. В ходе морфологического исследования препаратов культи червеобразного отростка в группах животных, оперированных с 31 использованием лазера и электрокоагуляции, выявлены существенные различия. При использовании высокоинтенсивного лазерного излучения выраженность экссудативной реакции и лейкоцитарной инфильтрации всех слоев культи была меньше в сравнении с электрокоагуляцией. После лазерной коагуляции культи аппендикса раньше появлялись соединительнотканные структуры в зоне воздействия. Даже спустя 30 суток после операции с использованием электрокоагуляции вокруг лигатур сохранялись лейкоцитарные муфты, в то время как при воздействии лазерным излучением шовный материал был окружен узкой полоской соединительной ткани. Для клинического использования лазерного излучения нами разработана оригинальная методика обработки культи червеобразного отростка, адаптированная к лапароскопической аппендэктомии (рис. 8). Рис. 8. Коагуляция слизистой оболочки червеобразного отростка лазерным излучением После лигирования основания червеобразного отростка последний пересекали эндоскопическими ножницами на 4/5 окружности. Непересеченный участок серозно-мышечной оболочки аппендикса использовали в качестве держалки. Через порт, расположенный в правой фланговой области по средне-ключичной 32 линии вводили аспиратор-ирригатор с рабочим каналом для световода лазера. Конец световода выводили из рабочего канала аспиратора-ирригатора на расстояние 1 см и подводили к слизистой оболочке культи червеобразного отростка на расстояние 3 мм, подавали лазерное излучение. Лазерную коагуляцию производили круговыми движениями по спиралевидной траектории от периферии к центру. После коагуляции отросток полностью отсекали эндоскопическими ножницами и удаляли из брюшной полости. О бактерицидных свойствах лазерного излучения сообщают многие исследователи [17, 30]. Наши наблюдения подтверждают эти данные. Анализ результатов бактериологических посевов с культи червеобразного отростка до и после лазерного воздействия показал, что до коагуляции бактерии высеяны в 79,3% наблюдений, а после воздействия высокоинтенсивного лазерного излучения микрофлора не высевалась. Отсутствие электрического потока в окружающих тканях при воздействии лазерным излучением делает процедуру значительно безопаснее электрокоагуляции. Необходимо отметить, что лазерную коагуляцию допустимо выполнять в непосредственной близости от металлических клипс и скобок. Таким образом, накопленный нами опыт использования высокоинтенсивного лазерного излучения ближнего инфракрасного диапазона при обработке культи червеобразного отростка позволяет сделать вывод о том, что высокомощные полупроводниковые лазеры на данном этапе операции могут быть достойной альтернативой электрохирургическим аппаратам при выполнении лапароскопической аппендэктомии. Погружной способ аппендэктомии предусматривает погружение обработанной лигатурным способом культи червеобразного отростка в купол слепой кишки кисетным швом или отдельными узловыми швами. Наиболее оптимальным шовным материалом являются нити “Polysorb” (фирма Auto Suture) или “Vicril” (фирма Ethicon) с условным диаметром 3/0−4/0, с колющими или лыжеобразными атравматическими иглами длиной 20−25 мм. 33 Техника наложения кисетного шва не отличается от таковой в открытой хирургии, однако, предпочтительнее наложение двойного S-образного полукисета по Русанову, что позволяет легче погрузить культю аппендикса. При наличии воспалительных изменений купола слепой кишки культю погружают отдельными узловыми серо-серозными швами. Узел, как правило, формируется интракорпорально. Погружной способ аппендэктомии технически более сложен, требует от хирурга навыка наложения эндоскопических швов, дополнительного инструментария, шовного материала, увеличивает время и стоимость операции. Поэтому мы используем погружной способ только при обоснованных сомнениях в надежности лигатурного способа, как правило, в следующих ситуациях: − при широком основании червеобразного отростка (более 1 см в диаметре); − при наличии воспалительных изменений основания червеобразного отростка и купола слепой кишки; − при возникновении в ходе операции осложнений, связанных с использованием лигатурного способа (соскальзывание лигатуры, пересечение аппендикса лигатурой, электрохирургический ожог культи или купола слепой кишки). Аппаратный способ обработки культи червеобразного отростка на сегодняшний день, бесспорно, признан самым быстрым, надежным и технически наиболее простым [4, 11, 14, 28, 35]. Основание аппендикса (если используется аппарат ENDO GIA 30 фирмы Auto Suture) прошивают синей кассетой с последующей обработкой культи 5% спиртовым раствором йода, спиртовым раствором хлоргексидина или высокоинтенсивным лазерным излучением. Если длина бранш аппарата позволяет захватить брыжейку, можно выполнить одновременное пересечение брыжейки и основания червеобразного отростка. Единственным недостатком способа является высокая стоимость аппарата и сменных кассет. В связи, с чем аппаратный способ аппендэктомии экономически оправдан в двух ситуациях: 34 − обоснованная необходимость сократить время операции (тяжелая сопутствующая патология, беременность и др.) − наличие выраженных деструктивных изменений основания аппендикса, когда необходимо произвести резекцию части купола слепой кишки. 2.6.4. Извлечение червеобразного отростка Извлечение червеобразного отростка без контакта с тканями брюшной стенки является принципиально важным моментом лапароскопической аппендэктомии. Аппендикс извлекают через любой установленный 10 мм троакар. Отросток захватывают за проксимальный конец на участке до лигатуры и осторожно втягивают в троакар, при необходимости ассистирующим инструментом «заправляют» в гильзу троакара оставшуюся на отростке часть брыжейки. Если диаметр отростка более 10 мм, 10 мм троакар заменяют на 12, 15 или 20 мм троакар в зависимости от диаметра аппендикса. В случаях, когда извлечению аппендикса препятствует оставшаяся на отростке часть брыжейки, последнюю срезают ножницами и извлекают отдельно. Червеобразный отросток с выраженными деструктивными изменениями (с перфорацией, фрагментацией) лучше извлечь в фабричном или самостоятельно изготовленном из перчатки контейнере. 2.6.5. Контрольная ревизия, санация, дренирование брюшной полости Для промывания брюшной полости наиболее часто используют водный 0,02% раствор фурацилина или водный 0,01% раствор хлоргексидина. Операционный стол переводят в строго горизонтальное положение. Санацию брюшной полости начинают с правой подвздошной ямки, удаляют экссудат, фибринозные наложения, сгустки крови, разделяют рыхлые сращения, контролируя надежность гемостаза брыжейки и состоятельность культи червеобразного отростка. Затем выполняется осмотр и при необходимости дозированное прицельное промывание «до чистых вод» других отделов 35 брюшной полости, вовлеченных в воспалительный процесс, начиная с верхнего этажа. Заканчивают санацию брюшной полости ревизией и промыванием малого таза, поднимают головной конец операционного стола и аспирируют всю жидкость из пространства Дугласа. Для повышения эффективности перитонеального лаважа И.С. Малков [24] рекомендует использовать ирригационно-аспирационное устройство БРЮСАН («Брюшной санитар»). В основу его конструктивного решения положен принцип одновременно функционирующей двухканальной системы притока и оттока жидкости, что обеспечивает работу аппарата в трех режимах: ирригации, аспирации, ирригации и аспирации. Устройство работает в режиме «пульсирующей» струи, что обеспечивает механический отрыв бактериальных токсинов от брюшины, позволяет удалять из брюшной полости сгустки крови, фибринные пленки, кишечное содержимое. Дренирование брюшной полости мы выполняем только при наличии перитонита или периаппендикулярного абсцесса. Количество дренажей зависит от распространенности перитонита. При наличии местного перитонита или периаппендикулярного абсцесса устанавливаем силиконовые трубки в малый таз и к ложу червеобразного отростка или в полость абсцесса. При распространенных формах перитонита необходимо дренировать трубчатыми или перчаточно-трубчатыми дренажами все отделы брюшной полости, вовлеченные в воспалительный процесс. При наличии обоснованных сомнений в адекватности санации брюшной полости через 24−48 часов целесообразно выполнить программированную санационную лапароскопию. 2.6.6. Завершение операции Под контролем видеокамеры из брюшной полости удаляют троакары, убеждаясь в отсутствии кровотечения из проколов передней брюшной стенки. Троакар для лапароскопа удаляют последним после десуффляции углекислого 36 газа из брюшной полости. Раны размерами 10 мм и более обязательно ушивают послойно с захватом апоневроза. У пациентов с ожирением для ушивания апоневроза удобно использовать скорняжные иглы. На раны размерами 5 мм накладывают только кожные швы. Показания и противопоказания к проведению видеолапароскопического грыжасечения герниопластики при паховой грыже 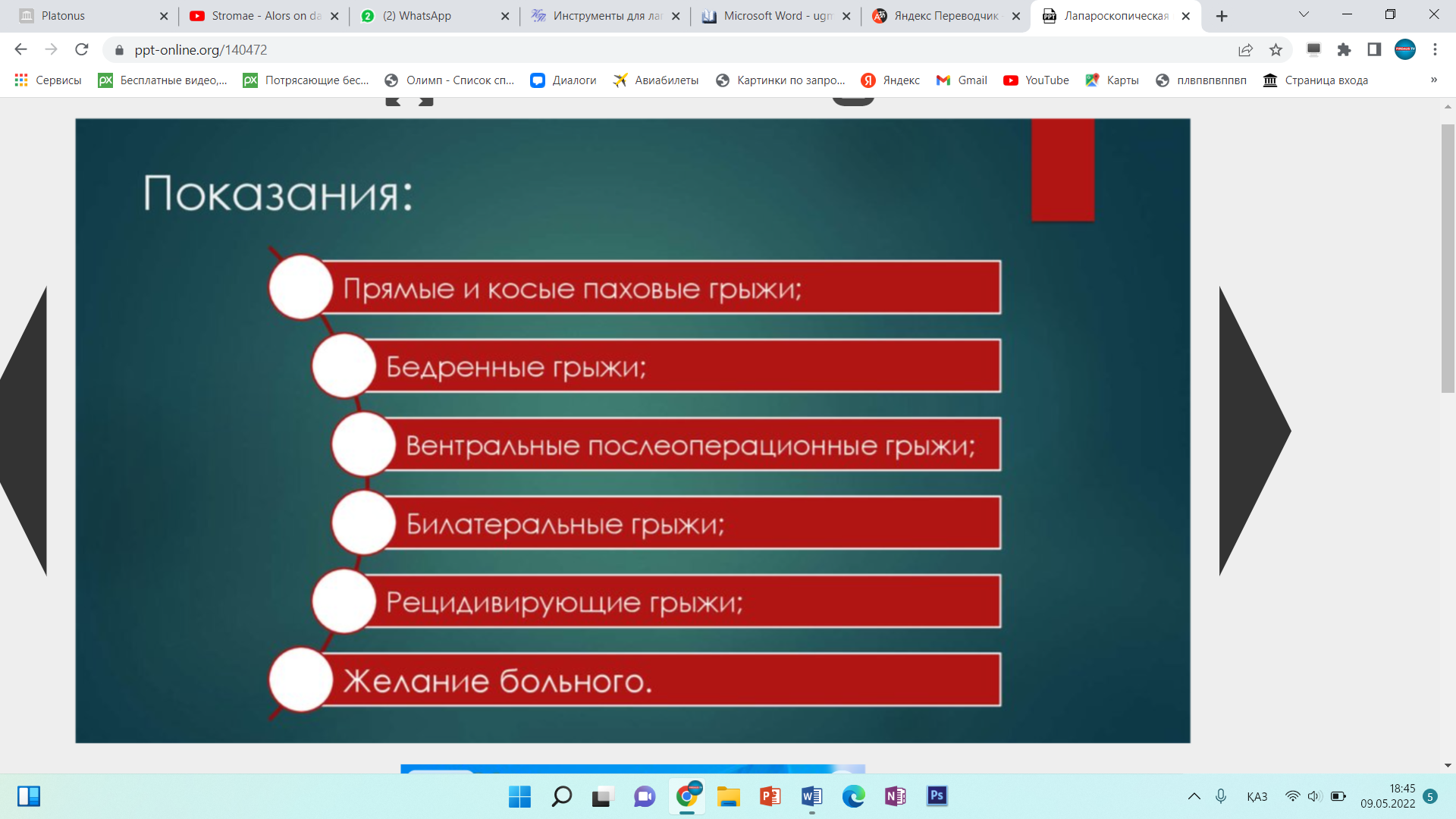 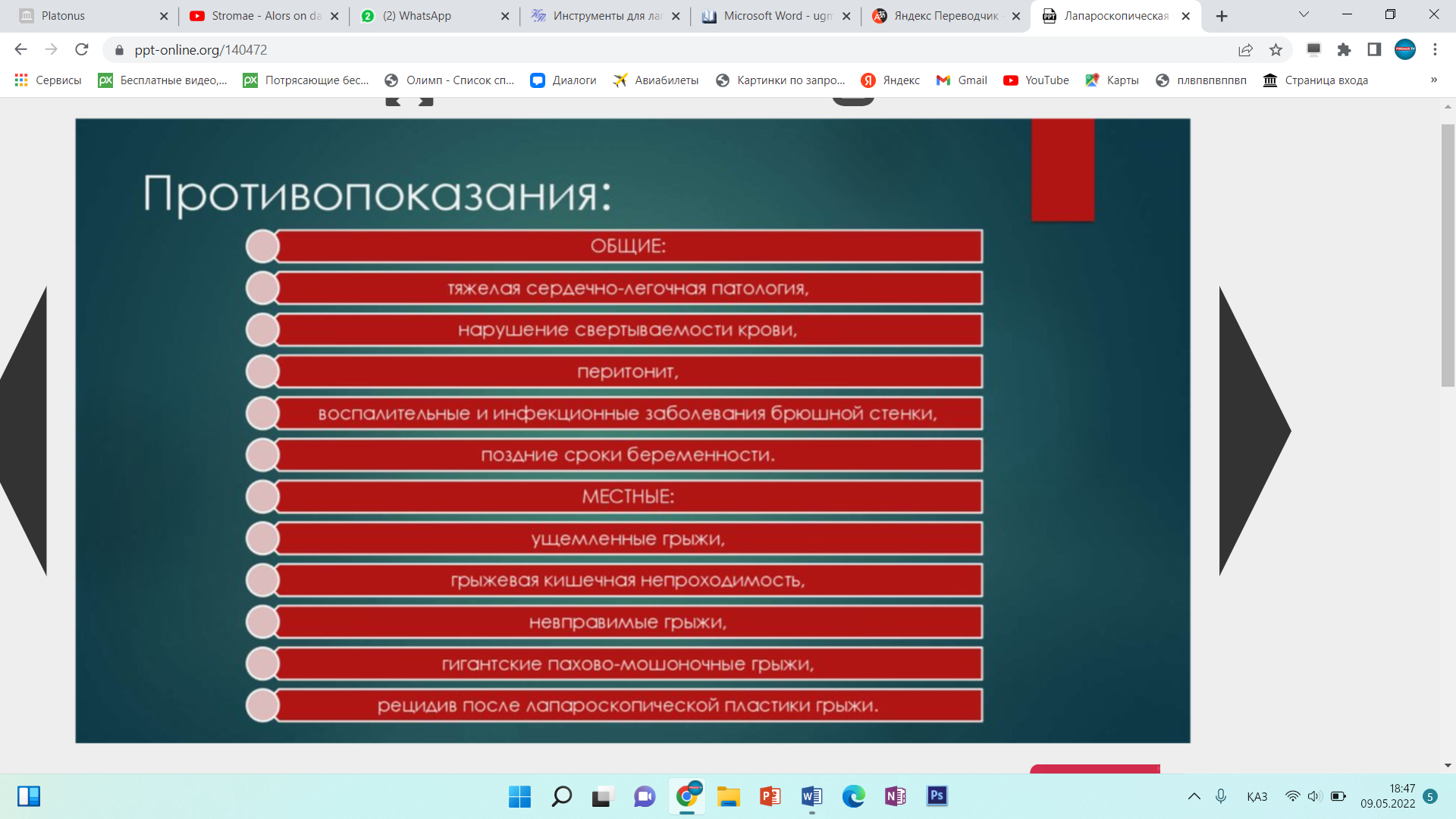 Этапы и техника проведения видеоассистированной торакоскопии. Набор инструментов необходимих для ВАТС. Набор инструментов необходимых для Видеоторакоскопической операций |