История классификации химических элементов. История классификации химических элементов
 Скачать 282.14 Kb. Скачать 282.14 Kb.
|
|
Федеральное государственное бюджетное образовательное учреждение высшего образования «Омский государственный аграрный университет имени П.А. Столыпина» ТС в АПК Кафедра математических и естествннонаучных дисциплин Направление – 36.03.01- ВСЭ Реферат по дисциплине Химия на тему: История классификации химических элементов Выполнил(а): ст. Б-12 группы Горшанова Е.В. Проверил(а): доц. канд. биол. наук Мицуля Т.П. Омск – 2022 г. Содержание Введение …………………………………………………………………3 1. Химический элемент………………………………………………….4 1.1 История открытия химических элементов…………….………..5 2. Классификация химических элементов………………………….…..6 Заключение ……………………………………………………………..10 Список литературы……………………………………………………..11 Приложение Введение Очень много различных вещей и предметов, живых и неживых тел природы нас окружает. И все они имеют свой состав, строение, свойства. В живых существах протекают сложнейшие биохимические реакции, сопровождающие процессы жизнедеятельности. Неживые тела выполняют различные функции в природе и жизни биомассы и имеют сложный молекулярный и атомарный состав. Но все вместе объекты планеты имеют общую особенность: они состоят из множества мельчайших структурных частиц, называемых атомами химических элементов. В общепринятом понимании химические элементы - это лишь графическое отображение атомов. Частиц, из которых складывается все существующее во Вселенной. То есть на вопрос: что такое химические элементы? можно дать такой ответ. Это сложные маленькие структуры, совокупности всех изотопов атомов, объединенные общим названием, имеющие свое графическое обозначение (символ). На сегодняшний день известно о 118 элементах, которые открыты как в естественных условиях, так и синтетически, путем осуществления ядерных реакций и радиоактивных распадов ядер других атомов. Каждый из них имеет набор характеристик, свое местоположение в общей системе, историю открытия и название, а также выполняет определенную роль в природе и жизни живых существ. Изучением этих особенностей занимается наука химия. Химические элементы - это основа для построения молекул, простых и сложных соединений, химических взаимодействий. 1. Химический элемент Химическим элементом называют определенный вид атомов. В настоящее время известно 118 химических элементов. Каждый элемент обозначают символом, который представляет одну или две буквы из его латинского названия. Например, элемент водород обозначают латинской буквой H и формулой H2 – первой буквой латинского названия элемента Hydrogenium. Все достаточно хорошо изученные элементы имеют символы и названия, которые можно найти в главных и побочных подгруппах Периодической системы, где все они расположены в определенном порядке. Что же является главным признаком, по которому атом относят к определенному элементу? Д. И. Менделеев и другие ученые-химики XIX века считали главным признаком атома массу как наиболее стабильную его характеристику, поэтому элементы в Периодической системе расположены в порядке возрастания атомной массы. По современным представлениям, главным свойством атома, относящим его к определенному элементу, является заряд ядра. Таким образом, химический элемент – это вид атомов, характеризующихся определенным значением (величиной) части химического элемента – положительного заряда ядра. Из всех существующих 118 химических элементов большую часть (около 90) можно обнаружить в природе. Остальные же получены искусственно с помощью ядерных реакций. Элементы 104-107 были синтезированы учеными-физиками в Объединенном институте ядерных исследований в городе Дубне. В настоящее время продолжаются работы по искусственному получению химических элементов с более высокими порядковыми номерами. Все элементы делятся на металлы и неметаллы. Более 80 элементов относятся к металлам. Однако это деление условное. При определенных условиях некоторые металлы могут проявлять неметаллические свойства, а некоторые неметаллы – металлические свойства. Содержание различных элементов в природных объектах колеблется в широких пределах. 8 химических элементов (кислород, кремний, алюминий, железо, кальций, натрий, калий, магний) составляют 99% земной коры по массе, все остальные – менее 1%. Большинство химических элементов имеют природное происхождение (95), хотя некоторые из них изначально были выведены искусственно (например, прометий). Следует различать понятия «простое вещество» и «химический элемент». Простое вещество характеризуется определенными химическими и физическими свойствами. В процессе химического превращения простое вещество утрачивает часть своих свойств и входит в новое вещество в виде элемента. Например, азот и водород, входящие в состав аммиака, содержатся в нем не в виде простых веществ, а в виде элементов. 1.1 История открытия химических элементов Само понимание того, что такое химические элементы, пришло только в XVII веке благодаря работам Бойля. Именно он впервые заговорил об этом понятии и дал ему следующее определение. Это неделимые маленькие простые вещества, из которых складывается все вокруг, в том числе и все сложные. До этой работы господствовали взгляды алхимиков, признававшим теорию четырех стихий - Аристотеля и Эмпидокла, а также открывших "горючие начала" (сера) и "металлические начала" (ртуть). Практически весь XVIII век была распространена совершенно ошибочная теория флогистона. Однако уже в конце этого периода Антуан Лоран Лавуазье доказывает, что она несостоятельна. Он повторяет формулировку Бойля, но при этом дополняет ее первой попыткой систематизации всех известных на тот момент элементов, распределив их на четыре группы: металлы, радикалы, земли, неметаллы. Следующий большой шаг в понимании того, что такое химические элементы, делает Дальтон. Ему принадлежит заслуга открытия атомной массы. На основе этого он распределяет часть известных химических элементов в порядке возрастания их атомной массы. Стабильно интенсивное развитие науки и техники позволяет делать ряд открытий новых элементов в составе природных тел. Поэтому к 1869 году - времени великого творения Д.И. Менделеева - науке стало известно о существовании 63 элементов. Работа русского ученого стала первой полной и навсегда закрепившейся классификацией этих частиц. Строение химических элементов на тот момент установлено не было. Считалось, что атом неделим, что это мельчайшая единица. С открытием явления радиоактивности было доказано, что он делится на структурные части. Практически каждый при этом существует в форме нескольких природных изотопов (аналогичных частиц, но с иным количеством структур нейтронов, от чего меняется атомная масса). Таким образом, к середине прошлого столетия удалось добиться порядка в определении понятия химического элемента. 2. Классификация химических элементов Попытки классификации химических элементов начались задолго до открытия Д.И. Менделеевым периодического закона. Естествоиспытатели в начале XIX в. сталкивались с большими трудностями в этом направлении, потому что химических элементов было известно всего 63, а атомные массы были определены для них неточно. Триады Дёберейнера В 1829 году немецкий химик Дёберейнер И.В. заметил, что некоторые сходные по своим свойствам элементы можно объединить по три в группы. Он назвал их триадами. Сущность данной классификации заключается в следующем: в каждой триаде есть средний элемент, масса атома которого будет равна средней арифметической массе двух крайних элементов. Например, рассмотрим первую триаду: Li, Na, K. Их атомные массы соответственно равны 7, 23, 39. 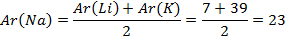 Система классификации Дёберейнера И.В. оказалась несовершенной.Некоторые триады не содержали тех элементов, которые были бы похожи с ними по химическим свойствам. Так, например, триада, содержащая S, Se, Te , не содержала кислорода O. Ошибка Дёберейнера И.В. заключалась в том, что он ограничил себя поиском тройственных союзов, т.е. триад. Но он был первым из естествоиспытателей, который связал свойства химических элементов с их атомными массами. Все дальнейшие попытки классификации химических элементов основывались на связи масс атомов с их химическими свойствами. Спираль Шанкуртуа В середине XIX века появилось много работ ученых, которые пытались классифицировать химические элементы. Французский геолог и химик Шанкуртуа А.Э. в 1862 году предложил свою классификацию химических элементов. Он расположил все известные к тому времени химические элементы в порядке возрастания их атомных масс, а полученный ряд нанес на поверхность цилиндра, по линии исходя из его основания под углом 45° к плоскости основания, так называемая земная спираль (см. рис.1).  Рисунок 1 – Спираль Шанкуртуа После развертывания этого цилиндра оказалось, что на вертикальных линиях, параллельных оси цилиндра, находятся химические элементы со сходными химическими свойствами. Так на одну вертикаль попадали Li, Na, K; а также Be, Mg, Ca. Кислород, сера, теллур. Недостатком спирали Шанкуртуа было то, что в вертикальную группу химических элементов попадали не имеющие ничего сходного с ними химические элементы. Так в группу щелочных металлов, попадал марганец. А в группу кислорода и серы, попадал титан. Октавы Ньюлендса В 1865 году 18 августа английский ученый Дж. А. Ньюлендс расположил химические элементы в порядке возрастания их атомных масс. В результате он заметил, что каждый восьмой элемент напоминает по свойствам первый элемент. Найденную закономерность, он назвал законом октав по аналогии с семью интервалами музыкальной гаммы (см. рис. 2). Закон октав он сформулировал следующим образом: 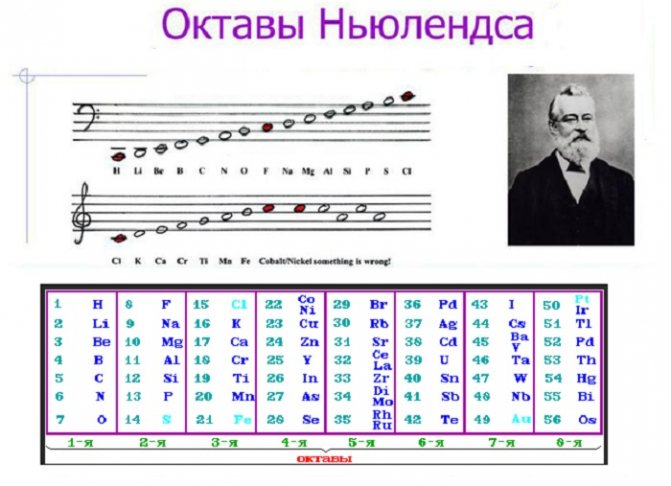 Рисунок 2 – Октавы Ньюлендса Он расположил элементы по семь в группы. Таким образом, он заметил, что вертикальные ряды, полученные после такого расположения, включают в себя элементы, схожие по своим химическим свойствам. Дж.А. Ньюлендс был первым, кто соотнес атомные массы химических элементов и их химические свойства и присвоил каждому элементу порядковый номер. Но все же в его таблице не было свободных мест. Он ограничил себя семью клетками в каждом периоде, и некоторые клетки ему пришлось поместить по несколько элементов. Поэтому научный мир отнесся скептически к его открытию. В 1864 году английский химик У. Одлинг опубликовал таблицу, в которой элементы были размещены, согласно их атомным весам и сходствам химических свойств. Но он не дал никаких комментариев к своей работе, и она не была замечена. Ю.Л. Мейер В 1870 году появилась первая таблица немецкого химика Ю.Л. Мейера под названием « Природа элемента, как функция их атомного веса». В неё были включены 28 элементов, размещенные в 6 столбцов, согласно их валентности. Ю.Л. Мейер намеренно ограничил число элементов в таблице, чтобы подчеркнуть закономерные изменения атомной массы в рядах сходных элементов (см. рис. 3). Сходные элементы располагаются в вертикальных рядах таблицы. Некоторые ячейки Ю.Л. Мейер оставил незаполненными.  Рисунок 3 – Таблица химических элементов Мейера Заключение Общее число попыток классификации элементов до Д.И. Менделеева, достигает пятидесяти. В них принимали участие ученые разных стран. Некоторым из них удалось подойти к предчувствию периодического закона, даже вступить на порог открытия его. И все же им не удалось довести свои попытки до конца. Их работы не были приняты учеными в качестве естественной классификации, так как все попытки сводились к объединению известных элементов в небольшие группы, установлению свойств между ними. Но не поднимались до обобщения, когда установленная закономерность естественного изменения свойств элементов способна не только отражать и объяснять известные факты, но и предвидеть ещё не познанные, предсказывать их закономерность. На эту ступень научного подвига смог подняться только Д.И. Менделеев. Дёберейнер, Ньюлендс, Шанкуртуа и Мейер – двигались по одной и той же дороге научного исследования. Все они по очереди подходили к лежавшему на пути науки драгоценному, но не обработанному камню. Каждый из них держал его в руках и каждый чувствовал, что камень этот не прост. Но один лишь гениальный Д.И. Менделеев оказался настолько проницательным, что не отбросил его в сторону, а смело принялся шлифовать и отрабатывать до тех пор, пока в руках у него не засияло во всём блеске величайшая ценность – периодический закон химических элементов – фундаментальный закон природы. Список литературы: 1.Ахметов Н.С. Общая и неорганическая химия. – М.: Высшая школа, 2019. 2.Бабкина С.С. Общая и неорганическая химия. Лабораторный практикум: Учебное пособие для бакалавров и специалистов / Бабкина С.С., Росин Р.И., Томина Л.Д.. - М.: Юрайт, 2016. - 481 c. 3.Бусев А.И. Определения, понятия, термины в химии / Бусев А.И., Ефимов И.П.. - М.: Просвещение; Издание 2-е, перераб., 2017. - 224 c. 4.Барагузина В.В. Общая и неорганическая химия: Учебное пособие / Барагузина В.В., Богомолова И.В., Федоренко Е.В.. - М.: ИЦ РИОР, 2017. – 272c. 5.Богомолова И.В. Неорганическая химия: Учебное пособие / Богомолова И.В.. - М.: Альфа-М, НИЦ ИНФРА-М, 2016. - 336 c. 6.Боровлев И.В. Органическая химия: термины и основные реакции / Боровлев И.В.. - М.: БИНОМ. ЛЗ, 2018. - 359 c.  |
