лабораторная работа по химии. Кислотноосновные буферные растворы. Приготовление буферных растворов по заданному рН. Применение метода нейтрализации
 Скачать 29.28 Kb. Скачать 29.28 Kb.
|
|
ЛАБОРАТОРНАЯ РАБОТА №3 Тема: Кислотно-основные буферные растворы. Приготовление буферных растворов по заданному рН. Применение метода нейтрализации (кислотно-основного титрования) для определения буферной емкости сыворотки крови.Исследование влияния разбавления на рН и буферную емкость. Актуальность: Цель работы: 1) Выбрать подходящий буфер по заданному значению рН, приготовить его и исследовать влияние разведения буфера на рН. 2) Определить буферную ёмкость сыворотки крови по кислоте и по основанию методом нейтрализации и сравнить эти показатели между собой, а также с нормальными показателями. Установить влияние разведения на буферную емкость. Оборудование и реактивы.Бюретки Пипетки на 5 мл и груши Колбочки конические для титрования Химические стаканчики, мензурки Уксусная кислота СН3СООН 0,1М Ацетат натрия СН3СООNa 0,1 М Дигидрофосфат натрия NaH2PO4 0,1М Гидрофосфат натрия Na2HPO4 0,1 М Гидроксид натрия NaOH 0,1э Соляная кислота HCl 0,1 э Индикаторы: спиртовые растворы 0,1% фенолфталеина и 0,1% метилового желтого. Универсальная индикаторная бумага Теоретическая часть Буферные системы – это системы, способные сохранять постоянное значение рН при разбавлении и при добавлении определенных количеств сильных кислот и оснований. Буферные системы могут быть образованы: 1. слабой кислотой и ее солью (СН3СООН + СН3СООNa; С6Н5СООН + С6Н5СООNa; НСООН + НСООNa;) 2. слабым основанием и его солью (NН4ОН (NН3.Н2О) + NН4С1) 3. кислой и средней солью слабой кислоты (NаНСО3 + Nа2СО3; Nа2НРО4 +Nа3РО4) 4. одно- и двухзамещенной солью слабой кислоты (Nа2НРО4 + NаН2РО4) Растворы, содержащие буферные смеси, способные вследствие этого противостоять изменению рН, называются буферными растворами. Для количественной характеристики способности буферного раствора противостоять влиянию сильных кислот и оснований используется величина, называемая буферной емкостью. По мере увеличения концентрации буферного раствора возрастает его способность сопротивляться изменению рН при добавлении кислот или щелочей. Буферная емкость – число эквивалентов кислоты или щелочи, которое следует добавить к 1 л буферного раствора, чтобы изменить рН на единицу (понизить при добавлении кислоты и повысить при добавлении щелочи) В=ν(1/Z*кислоты) или В=ν(1/Z*основания)ΔpH×VΔpH×V где V – объем буферного раствора, л.; ν(1/Z*Х) - количество эквивалента кислоты или щелочи, моль; ν(1/ Z*Х) = C(1/ Z*Х)×V(Х); c(1/ Z*Х) – молярная концентрация эквивалента кислоты (щелочи), моль/л; V(Х) – объем раствора кислоты (щелочи), л; ∆рН – изменение рН после добавления кислоты (щелочи). Величина буферной емкости зависит от концентрации компонентов буферной смеси и их отношения между этими концентрациями. С увеличением концентрации компонентов буферной смеси буферная емкость увеличивается. При разбавлении буферной смеси буферная емкость уменьшается. Буферная емкость максимальна при одинаковых концентрациях соли и кислоты или соли и основания в буферной смеси. Если молярные концентрации эквивалента кислоты и соли равны, то рН буферной смеси будет равен рК к-ты. Следовательно, для приготовления буферной системы с наибольшей буферной емкостью надо выбирать кислоту с наиболее близкой к заданному значению рН величиной рКк-ты (рН ≈ рКк-ты). Для смесей, образованных слабым основанием и его солью, рН = 14 – рКосн., т.е. рКосн. ≈ 14 - рН. Свойства буферных растворов 1. рН буферного раствора зависит от отношения концентраций компонентов буферных систем, а также свойств буферной пары и растворителя. 2. Различные буферные растворы обладают определенной буферной емкостью и сохраняют постоянство рН только до прибавления определенного количества кислоты или щелочи. 3. Буферная емкость тем больше, чем выше концентрация компонентов буферного раствора. Максимальная буферная емкость наблюдается у растворов, которые содержат равные концентрации компонентов буферной пары. Во внеклеточной и внутриклеточной жидкости существуют четыре основные буферные системы: – бикарбонатная; – белковая; – гемоглобиновая; – фосфатная. Главными буферами внеклеточной жидкости является бикарбонатный и гемоглобиновый, в то время как белки и фосфаты — это основные внутриклеточные буферы. Бикарбонатный буфер является основным и наиболее лабильным внеклеточным буфером. Он состоит из угольной кислоты и бикарбонатня (гидрокарбоната) натрия; константой, характеризующей буфер соотношение концентраций кислоты и ее кислой соли. Внеклеточная буферная система угольной кислоты и гидрокарбоната натрия нейтрализует примерно 40% всех высвобождаемых ионов водорода. Эта буферная система уникальна тем, что Н2СО3 может диссоциировать на Н2О воду и СО2. В то время как другие буферы быстро становятся неэффективными в результате связывания водородных ионов и анионов слабой кислоты, бикарбонатные системы поддерживают работоспособность в связи с удалением Н2СО3в виде СО2. Лимитирующим параметром эффективности бикарбонатной системы является, по сути дела, начальная концентрация бикарбоната Практическая часть Ход работы: Задача 1. Выбрать и приготовить подходящий буфер в объеме 20 мл для поддержания заданного значения рН. Порядоквыполнениязадачи(опыта)№1: Получить от преподавателя индивидуальные значения рН. С учетом этого значения рН выбрать подходящий буфер из двух представленных: ацетатного - рКа 4,8 и фосфатного – рКа 6,8. Рассчитать объемы компонентов выбранного буфера с учетом того, что концентрации компонентов одинаковы. Отмерить пипеткой (или мензуркой) рассчитанные объемы кислотного и основного компонентов буфера и перенести их в стаканчик. Перемешать. Определить рН приготовленного буфера по индикаторной бумажке и использовать этот буфер для решения задачи 2. Для проведения этого опыта мы приготовили ацетатный буфер объемом 20 мл с pH=7 воспользовавшись формулой Гендельсона – Гассельбага: pH= pKa+lg 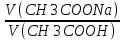 Kg(CH3COOH)= 1,8  ; ;PKa= 4,76 lg 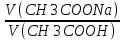 = 0,24 Vk=1; Vk+V0=1+1,7=2,7 = 0,24 Vk=1; Vk+V0=1+1,7=2,7V0=1,7 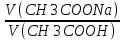 = 1,7 = 1,720:2,7=7,4 кислоты 20-7,4=12,6 основания Вывод: После проведения данного опыта мы поместили в него индикаторную бумажку, она показала pH=7, что означает правильность приготовленного нами раствора. Задача 2. Выяснить и объяснить, что произойдет с рН буфера при разбавлении его водой. Порядоквыполнениязадачи (опыта)№2: В отдельный стаканчик отмерить пипеткой 1 мл буферного раствора, приготовленного в первом опыте. Это будет опытнаяпроба. Исходный буфер послужит контролем. Разбавить опытную пробу водой в 10 раз. С помощью индикаторной бумажки определить рН в опытной пробе и полученное значение сравнить с контролем. Сделать вывод и объяснить результат. 1)Сначала разделим буфер на две части 2) В одну колбу наливаем 10 мл раствора буфера и разбавим его 2 раза, далее при помощи индикатора измерим pH получившегося раствора. По образовавшемуся цвету в колбе сравним его с изначальным, таким образом получаем, что pH почти не изменился (цвета идентичны) 3) В другую колбу нальем 1 мл буфера и заведем его в 10 раз. При помощи индикатора также определим pH получившегося раствора. В колбе образовался цвет, мы сравниваем его с изначальным результатом. Вывод: Получилось, что цвет второго индикатора совпадает с цветом первого, что говорит о равных pH, следовательно буфер остается неизменным. Задача 3. Определить буферную емкость сыворотки крови по кислоте и по основанию, используя метод нейтрализации. Порядоквыполнениязадачи(опыта)№3: Заполнить бюретку титрованным (0,1э) раствором HCl. В две колбы для титрования внести пипеткой по 5 мл сыворотки крови, рН которой 7,4. В одну из колб прибавить 2-3 капли индикатора метилового желтого и титровать из бюретки раствором НСl до появления оранжевой окраски (рН ≈ 3,4). По бюретке отметить объём израсходованной кислоты и, зная её концентрацию, рассчитать буферную емкость сыворотки крови по кислоте. Слить из бюретки раствор HCl и промыть бюретку водой. Заполнить бюретку титрованным (0,1э) раствором NaOH. Во вторую колбу с сывороткой крови прибавить 2 капли фенолфталеина и титровать из бюретки раствором NаОН до появления малиновой окраски (рН ≈ 9,4). 8)Отметить по бюретке объём потраченной щёлочи и, зная его концентрацию, рассчитать буферную ёмкость сыворотки крови по основанию. 9)Убедиться, что буферная ёмкость сыворотки крови по кислоте больше, чем буферная ёмкость по основанию. Сравнить с нормами и сделать вывод. 1)Изначально подготавливаем растворы для опытов: отмеряем и наливаем в две колбы сыворотку крови объемом 5 мл и pH=7,4-8. 2) В одну из них добавим несколько капель фенолфталеина, а затем с помощью метода титрования прильем гидроксида натрия до появления розовой окраски раствора. Определим буферную ёмкость по основанию с фенолфталеином: B=  3) Во вторую колбу добавим соляную кислоту и другой индикатор- вместо фенолфталеина(который в кислоте не даст окраса) добавим метилоранж (который проявляется в кислой среде) до проявления оранжевой окраски. Определяем буферную ёмкость по кислоте: B=  Вывод: Буферная ёмкость сыворотки крови по кислоте получилась действительно больше, чем по основанию. Опят выполнен верно. Вопросы для защиты: 1. От чего зависит pH буферного раствора? Зависит от природы слабого электролита (рК кислоты), (рК основания), от соотношения концентрации соли и кислоты (основания) и от температуры. 2. Каким будет значение рН буферного раствора если кислота и сопряженное с ней основание содержатся в эквимерярных количествах. Поддерживает постояноство среды (6.8-7.8) 3. Каким будет значение рН буферного раствора при преобладании Кислот или оснований? Происходит смещение равновесия Ацетатный- 3,7-5,6 Аммиачный- 8,4-10,3 Фосфатный- 5,4-8,0 4. При каких значениях рН буфер будет иметь оптимальную буферную емкость. Интервал буферного действия: рН= рКа±1 5. Как правильно выбрать буфер для поддержания требуемого рН? Буферная смесь должна быть такой, чтобы количество вносимых в раствор сильных кислоты или щелочи не превышало определенной величины(±10%) 6. рН=рК2+  рК2= -lgК2- величина берется из справочника 7. Расчет объема кислотного буфера ? рН= рК(кислоты)+lg 8. Почему при добавлении к буферу pH не изменяется? Потому что константа диссоциации и соотношение компонентов при этом остаются неизменными. 9. Для чего определяют буферную емкость по кислоте, по основанию? Способность буферного раствора сохранять свой рН определяется его буферной емкостью- количеством сильной кислоты или основания, которые следуют прибавить к 1 л. Буферного раствора чтобы его pH изменился на единицу. |
