Классификация ВМС. Классификация вмс высокомолекулярные соединения (полимеры) вещества с очень большой молекулярной
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
|
Классификация ВМС Высокомолекулярные соединения (полимеры) — вещества с очень большой молекулярной массой, молекулы которых содержат повторяющиеся группировки атомов. Полимеры можно классифицировать по: 1) происхождению (природные, синтетические и искусственные); 2) пространственной структуре (линейная, разветвлённая, сетчатая); 3) пространственной последовательности соединения исходных молекул мономеров в макромолекуле полимера (стереорегулярные и нестереорегулярные); 4) способу получения (реакция полимеризации и реакция поликонденсации), 5) способности сохранять свои свойства после нагревания (термопластичные и термореактивные). Макромолекула - молекула полимера Мономеры - низкомолекулярные соединения, из которых образуются полимеры. Структурное звено -группа атомов, многократно повторяющаяся в цепной макромолекуле. Степень полимеризации - число, показывающее сколько молекул мономера соединилось в макромолекулу. Степень полимеризации обозначается индексом "" за скобками, включающими в себя структурное (мономерное) звено.  Полимерные макромолекулы представляют собой длинные цепочки, состоящие из большого количества отдельных звеньев Классификация полимеров 1. По происхождению полимеры бывают природными, синтетическими, т. е. полученными из мономеров, и искусственными, т. е. полученными в результате химической обработки природных полимеров.  Рис. 1. Классификация полимеров по происхождению 2. По пространственной структуре различают линейные, разветвлённые и сетчатые (сшитые) полимеры.  Рис. 2. Пространственная структура полимеров: а) линейная; б) разветвлённая; в) сетчатая Линейные и разветвленные полимеры способны образовывать прочные эластичные волокна и плёнки, которые могут плавиться и способны растворяться в различных растворителях. Примерами линейных полимеров полиэтилен, поливинилхлорид, разветвлённых — амилопетин, натуральный каучук. В сетчатых полимерах углеродные цепи «сшиты» между собой и образуют пространственную структуру, в которой вещество представляет собой одну гигантскую молекулу. Примерами полимеров с сетчатой структурой фенолоформальдегидные смолы, вулканизированные каучуки с большим содержанием серы. Такие полимеры неэластичны и нерастворимы.  3. По последовательности соединения исходных молекул мономеров в макромолекуле полимера различают стереорегулярные и нестереорегулярные полимеры. Стереорегулярность оказывает большое влияние на свойства полимеров. Стереорегулярные полимеры - полимеры, макромолекулы которых построены из звеньев одинаковой пространственной конфигурации или же из звеньев различной конфигурации, но обязательно чередующихся в цепи в определенном порядке.   Нестереорегулярные полимеры - полимеры с произвольным чередованием звеньев различной пространственной конфигурации.  Рис. 5. Строение нестереорегулярных полимеров 4. По способу получения. Существует два основных способами получения полимеров — реакции полимеризации и реакция поликонденсации.  Рис. 6. Классификация полимеров по способу получения Полимеризация реакция образования высокомолекулярных соединений путём последовательного присоединения молекул мономера к растущей цепи за счет разрыва кратных связей. В процессе полимеризации не происходит образования побочных низкомолекулярных веществ. Сополимеризация процесс полимеризации с участием двух или более разных мономеров Сополимер полимер, образованный из двух или более мономеров Примерами сополимеризации являются процессы получения бутадиен-стирольных, бутадиен-нитрильных каучуков, например: 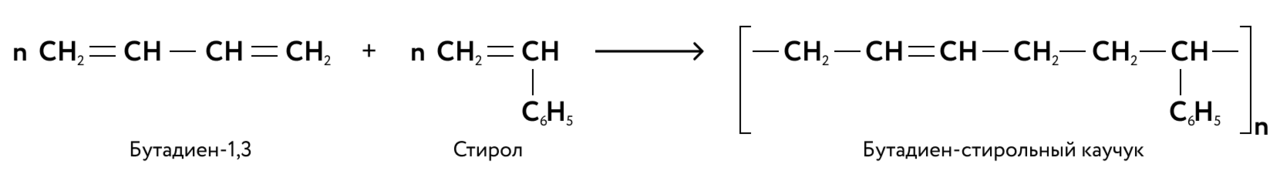 Реакция полимеризации включает в себя три основных стадии: зарождение цепи, т. е. образование активных центров (свободных радикалов или ионов), рост цепи и обрыв цепи. Поликонденсация процесс образования молекул полимеров за счёт взаимодействия между функциональными группами одинаковых или различных молекул мономеров сопровождающийся выделением побочных низкомолекулярных продуктов (например, воды). В поликонденсацию могут вступать соединения, содержащие не менее двух функциональных групп, способных к химическому взаимодействию. В основе реакции поликонденсации большинства синтетических полимеров лежат реакции образования амидов или сложных эфиров. Например, аминокислоты , содержащие карбоксильную группу и аминогруппу , используют для получения полиамидов. Реакции поликонденсации, в которых участвуют молекулы двух или нескольких разных мономеров, называют реакциями сополиконденсации. В результате реакции сополиконденсации в живых организмах происходит синтез белковых молекул из разных аминокислот, в промышленности получают полиэтилентерефталат, фенолформальдегидные смолы и др.  Рис. 6. Схема получения фенолформальдегидной смолы 5. По способности сохранять свои свойства после нагревания различают термопластичные и термореактивные полимеры. Термопластичные полимеры полимеры, которые могут многократно изменять свою форму при нагревании и последующем охлаждении. Термопластичные полимеры имеют линейную структуру, между отдельными молекулами которых отсутствуют прочные химические связи. легко размягчаются, не разрушаются при плавлении и выдерживают многократное нагревание и охлаждение. Их можно использовать для многократной переработки. полиэтилен, полипропилен, полиметилметакрилат Термореактивные полимеры полимеры, которые при нагревании изменяют свою форму, но при этом теряют пластичность и становятся твёрдыми. Термореактивные полимеры имеют сетчатую (сшитую) структуру и характеризующуюся наличием прочных ковалентных связей между отдельными макромолекулами. Термореактивные полимеры при нагревании разлагаются. При этом происходит необратимое изменение или даже разрушение их структуры. Эти пластмассы нельзя использовать для многократной переработки. К числу термореактивных полимеров относятся фенолформальдегидные смолы (получаются путём поликонденсации формальдегида с фенолом), аминопласты (получаются путём поликонденсации формальдегида с мочевиной), эбонит. Физические свойства полимеров Полимеры не имеют определённой температуры плавления, так как содержат макромолекулы различной массы, и при нагревании они постепенно размягчаются. Многие полимеры обладают низкой растворимостью; сетчатые полимеры вообще нерастворимы, а лишь набухают за счёт поглощения растворителя. Растворы полимеров обладают высокой вязкостью при малой концентрации растворённого вещества. Полимеры обладают особыми механическими свойствами, к которым относятся: эластичность — способность к высоким обратимым деформациям при относительно небольшой нагрузке, что особенно характерно для каучуков; малая хрупкость стеклообразных и кристаллических полимеров, например органического стекла; способность макромолекул к ориентации под действием направленного механического поля, что используется при изготовлении волокон и пленок.  Ещё одна особенность полимеров — их способность к старению, т. е. к потере характерных свойств. При старении полимеры могут размягчаться, но часто, наоборот, происходит повышение их твёрдости и хрупкости и потеря эластичности. Для замедления процесса старения в полимеры добавляют стабилизаторы — различные органические вещества, ослабляющие действия факторов, способствующих старению. Ещё одна особенность полимеров — их способность к старению, т. е. к потере характерных свойств. При старении полимеры могут размягчаться, но часто, наоборот, происходит повышение их твёрдости и хрупкости и потеря эластичности. Для замедления процесса старения в полимеры добавляют стабилизаторы — различные органические вещества, ослабляющие действия факторов, способствующих старению.Белки — высокомолекулярные природные полимеры, состоящие из аминокислотных остатков, соединенных пептидной связью; являются главной составной частью живых организмов и молекулярной основой процессов жизнедеятельности. Важно уточнить, что в состав белков входит только 20 альфа-аминокислот Общая формула белков выглядит следующим образом:  Греческая приставка «альфа-» в названиях альфа-аминокислот взялась из систематической номенклатуры. По ее правилам, следующий после карбоксильной группы углерод получает название первой буквы греческого алфавита — альфа, затем идет буква бета и так далее. В названии аминокислоты указывается греческая буква того углерода, у которого есть заместитель, в данном случае — аминогруппа.  альфа-аминопропановой кислотой. альфа-аминопропановой кислотой.Рассматривая строение молекулы, можно увидеть две конкурирующие по свойствам группы: карбоксильную, которая отвечает за кислотные свойства, и аминогруппу, которая отвечает за оснóвные свойства. Две молекулы аминокислот и более могут вступать в реакцию между собой, реагируя по разным функциональным группам. Именно таким образом получается пептид:  Соединение, которое образуется в результате взаимодействия двух аминокислот, называется дипептидом. Благодаря наличию двух свободных функциональных групп (карбоксильной и аминогруппы) дипептид может взаимодействовать с другими аминокислотами, увеличивая свое строение и превращаясь в полипептид. Первичная структура белка — это простейший вид белковой структуры. Представляет собой последовательность аминокислот в полипептидной цепи. Последовательность аминокислот в белке определяется ДНК, а именно геном, кодирующим этот белок. Вторичная структура — пространственная структура, которая образуется в результате взаимодействия функциональных групп пептидного остова (полипептидная цепь без атомов R-групп). Самые распространенные формы вторичной структуры — это α-спираль и β-лист. Обе структуры удерживают форму благодаря водородным связям Третичная структура — это пространственное строение всей молекулы белка, состоящей из единственной цепи. Эта структура обусловлена взаимодействиями между R-группами аминокислот, которые входят в состав белка. водородные, ионные и диполь-дипольные связи, а также дисперсионные силы. Четвертичная структура — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Для клинической биохимии имеет значение возможность снятия заряда с белковой молекулы, т.е. перевода ее в изоэлектрическое состояние (ИЭС). ИЭС – это состояние белка, когда он электронейтрален. Перевести белок в ИЭС можно, изменяя рН среды. То значение рН, когда заряд белковой молекулы равен нулю, называют изоэлектрической точкой (ИЭТ). Для нейтральных белков ИЭТ лежит в слабокислой среде, рН≤7, т.е. к такому белку нужно добавить немного кислоты (Н+ ), чтобы нейтрализовать незначительный отрицательный заряд. Отсюда ИЭТ кислых белков лежит в кислой среде, рН7 – т.к. нужно добавлять ОН– для нейтрализации их положительного заряда. Вокруг заряженных групп будут собираться диполи воды, формируя гидратную оболочку. Отсюда факторами устойчивости белка в растворе являются 1) наличие заряда и 2) наличие гидратной оболочки. Поэтому, чтобы осадить белок, т.е. перевести его в нерастворенное состояние, нужно воздействовать на эти факторы. Снятие заряда осуществляется путем подведения рН к ИЭТ. Снятие гидратной оболочки осуществляется: 1) Водоотнимающими средствами – соли щелочных металлов в высоких концентрациях (например, сернокислый аммоний), спирт, ацетон. 2) При денатурации белка – т.е. при разрушении всех пространственных структур. При осаждении белков солями щелочноземельных металлов белки не подвергаются глубоким изменениям и могут быть растворены, если убрать соли (например, диализом). Такой метод осаждения белков называют высаливанием. Реакции осаждения белков используют в медицине для выделения и обнаружения белка в биологических жидкостях – крови, моче. Устойчивость ВМС в растворе 1) Гидратная оболочка макромолекулы. Когда макромолекула белка теряет гидратную оболочку (например, при попадании в спирт), устойчивость макромолекулы резко снижается и она коагулирует. 2) Электрический заряд макромолекулы, который появляется в результате её ионизации: диссоциации карбоксильных групп и ассоциации аминогрупп.  При определённом значении рН степень ионизации обеих групп становится одинаковой и тогда наступает изоэлектрическое состояние макромолекулы (общий молекулы заряд равен 0). Значение рН, при котором макромолекула находится в изоэлектрическом состоянии, называется изоэлектрической точкой. В изоэлектрическом состоянии макромолекула теряет устойчивость и коагулирует, т.е.в изоэлектрической точке самая высокая скорость коагуляции. Кроме того, лишенная заряда, макромолекула ВМС (изоэлектрическое состояние) в электрическом поле будет неподвижной, поэтому в ИЭТ электрофорез ВМС не идет. Чтобы в электрическом поле макромолекула перемещалась к какому-либо из электродов надо изменить рН раствора.  Набухание и растворение полимеров Процесс растворения ВМС протекает самопроизвольно, но в течение длительного времени, и ему часто предшествует набухание полимера в растворителе. Полимеры, макромолекулы которых имеют симметричную форму, могут переходить в раствор, предварительно не набухая. Например, гемоглобин, печеночный гликоген при растворении почти не набухают, а растворы этих веществ не обладают высокой вязкостью даже при сравнительно больших концентрациях, в то время как вещества с более асимметрическими вытянутыми молекулами при растворении очень сильно набухают (желатин, целлюлоза, натуральный и синтетические каучуки). Набухание- увеличение массы и объема полимера за счет проникновения молекул растворителя в пространственную структуру ВМС. Причина набухания - большая разница в размерах молекул растворяемого вещества и растворителя и, как следствие, большое различие в скоростях их диффузии. При набухании вначале происходит практически односторонняя диффузия молекул растворителя в пространственную сетку полимера, имеющая ту же природу, что и осмос растворителя в осмотическую ячейку через поры полупроницаемой мембраны. Механизм набухания сводится к проникновению молекул растворителя в ближайшие слои полимера и сольватации соответствующих участков полимерной цепи. В результате макромолекулы «разрыхляются», что облегчает дальнейшее проникновение молекул растворителя и увеличение массы и объема полимера. Различают два вида набухания: неограниченное, заканчивающееся полным растворением ВМС (например, набухание желатины в воде, каучука в бензоле, нитроцеллюлозы в ацетоне) и ограниченное, приводящее к образованию набухшего полимера - студня (например, набухание целлюлозы в воде, желатины в холодной воде, вулканизованного каучука в бензоле). Студень представляет собой пространственную сетку, состоящую из связанных между собой макромолекул полимера и заполненную молекулами растворителя. Степень ограниченности процесса набухания и возможность самопроизвольного растворения определяются соотношением энергии связи в решетке полимера и энергии сольватации полимерной цепи с учетом энтропийного фактора. Весь процесс набухания и растворения ВМС можно условно разделить на ряд стадий: (рис. 1). 1. На начальной стадии (рис. 1, а) система состоит из двух компонентов: полимера и низкомолекулярной жидкости. 2. Переход а —> б характеризуется интенсивным проникновением молекул низкомолекулярной жидкости в структуру полимера и сольватацией полимерной цепи, сопровождающимся выделением теплоты (ΔН < 0). Изменение энтропии по сравнению с энтальпийным фактором незначительно. При этом объем полимера возрастает, но общий объем системы «полимер-растворитель» уменьшается. Это явление называется контракцией,а выделение теплоты говорит о физико-химической природе процесса. 3. Переход б -> в представляет собой начальный этап распределения макромолекул полимера по всему объему растворителя и характеризуется возрастанием энтропии системы вследствие роста числа возможных конформаций. Энтальпия системы если и изменяется, то незначительно. На данном этапе обычно происходит основное увеличение объема и массы полимера, что является результатом дальнейшего проникновения молекул растворителя в полимерную сетку, ее разрыхление и связанное с этим частичное освобождение макромолекул. Отдельные макромолекулы начинают отрываться друг от друга и переходить в слой низкомолекулярной жидкости. Ограниченное набухание заканчивается на стадии б или в образованием студня. Дальнейшее развитие процесса - неограниченное набухание - приводит к растворению полимера, т.е. к образованию раствора ВМС. 4. Переход в -> г происходит в результате сил диффузии и характеризуется значительным увеличением энтропии системы. При этом макромолекулы ВМС равномерно распределяются по всему объему низкомолекулярного растворителя, образуя истинный раствор. Так как растворение полимеров главным образом обусловлено ростом энтропии, то и устойчивость растворов ВМС объясняется в основном энтропийным фактором.  Набухание и растворение ВМС зависят от: 1. природы растворителя и полимера, 2. строения макромолекул полимера, 3. температуры, 4. присутствия электролитов, 5. от рН среды (для полиэлектролитов). Процессы набухания и растворения, ВМС являются избирательными процессами. Для образования раствора ВМС необходимо его сродство с растворителем (лиофильность). Неполярные полимеры хорошо набухают (растворяются) в неполярных растворителях (каучук в бензоле или бензине) и не набухают в полярных. Полярные полимеры лучше набухают (растворяются) в полярных жидкостях (белок в воде) и не набухают в неполярных. Из-за сродства полимера с растворителем при набухании и растворении большая часть растворителя «связывается» в сольватные (гидратные) оболочки. Особенно это характерно для полярных макромолекул в водной среде. И поскольку макромолекулы обладают большой поверхностью, то для неограниченного набухания (растворения) даже в лиофильной системе требуется достаточное количество жидкости. Иначе процесс набухания может остановиться на стадии ограниченного набухания, т.е. образования студня. Существенную роль в набухании играет строение макромолекул полимера. Например, полимеры с длинными жесткими цепями и большим количеством полярных групп хорошо набухают, но не растворяются даже в соответствующем растворителе (целлюлоза в воде). Если полимер растворяется в жидкости не достаточно хорошо, то также образуется студень. Температура на эти процессы влияет в соответствии с принципом Ле Шателье. Поскольку набухание сопровождается выделением теплоты на первом этапе, то с повышением температуры степень набухания, а также растворимость полимера, уменьшаются. На второй стадии набухание может стать эндотермическим процессом. в этом случае набухание с возрастанием температуры увеличивается. Например, если в холодной воде желатина набухает ограниченно, то с повышением температуры - неограниченно, т.е. растворяется. При охлаждении полученного раствора снова образуется студень. Однако скорость набухания (растворения) полимеров с увеличением температуры растет ввиду увеличения скорости диффузии. Действие ионов электролитов на набухание полярного ВМС связано с их способностью к гидратации. Поскольку анионы гидратируются больше, чем катионы, то катионы влияют на набухание этих полимеров незначительно. По способности уменьшать набухание анионы располагаются в так называемый лиотропный ряд или ряд Гофмейстера (при одном и том же катионе): СNS- < I- < Вr- < NO3- < СI- < СН3СОО- < SO42- Ионы СNS- усиливают набухание вследствие того, что, слабо гидратируясь, они хорошо адсорбируются на макромолекулах ВМС. А ионы SO42- процесс набухания тормозят, так как сульфат-ионы сильнее всех анионов этого ряда гидратируются, уменьшая этим количество «свободной» (не связанной в гидратные оболочки) воды. Влияние рН среды особенно значительно для высокомолекулярных электролитов (белков, нуклеиновых кислот, производных целлюлозы и крахмала). Минимум набухания отмечается в ИЭТ, поскольку в ней суммарный электрический заряд макромолекул белков и, соответственно, степень их гидратации минимальны. При более низких или более высоких значениях рН увеличивается ионизация функциональных групп, что приводит к расталкиванию одноименно заряженных участков полимерной цепи и ее разрыхлению. Вследствие этого молекулы воды легче проникают в пространство между цепями, что отражается на величине набухания в сторону ее увеличения. Количественной характеристикой ограниченного набухания полимеров является степень набухания α, определяемая отношением приращения массы (т - т0) или объема (V- V0) полимера к его первоначальной массе то(объему V0):  где т - масса (V- объем) набухшего полимера. Набухание полимеров сопровождается возникновением давления, которое назвали давлением набухания(≈ 5∙105-10∙105 Па). Механизм его возникновения подобен механизму возникновения осмотического давления. Это давление легко обнаруживается, когда какое-либо препятствие мешает увеличению объема полимера. Растворы ВМС - устойчивые системы, однако при определенных условиях возможно нарушение устойчивости, что приводит к высаливанию, коацервации, застудневанию. Высаливание ВМС. Растворы ВМС образуются самопроизвольно и являются термодинамически устойчивыми. Под влиянием электролитов происходит процесс выделения ВМС из раствора, называемый высаливанием. Для разрушения раствора ВМС требуется большая концентрация электролита. В основе механизма высаливания ВМС лежит процесс дегидратации. Ионы введенного электролита и молекулы спирта как бы «отнимают» большую часть растворителя от макромолекулы полимера. Концентрацию электролита, при которой наступает быстрое осаждение полимера, называют порогом высаливания ВМС. Высаливающее действие ионов изменяется в соответствии с их гидратируемостью. Высаливание ВМС имеет большое практическое значение. Его применяют для фракционирования белков, полисахаридов и других веществ. В фармацевтической технологии высаливание часто применяют в производстве ферментных и других препаратов из животного сырья с целью осаждения примесей сопутствующих белков или для выделения действующего белка (гормона, фермента). В аптечной технологии лекарств высаливающее действие электролитов, а также этилового спирта, сахарного сиропа, учитывают при изготовлении растворов ВМС. Этиловый спирт и большие количества электролитов несовместимы с раствором ВМС. Коацервация. При нарушении устойчивости раствора ВМС возможно образование коацервата - новой жидкой фазы, обогащенной полимером. Это явление носит название коацервации и характерно для ряда белков. Оно заключается в разложении системы на две фазы, из которых одна представляет собой раствор ВМС в растворителе, а другая - раствор растворителя в ВМС. Коацерват может находиться в исходном растворе в виде капель или образовывать сплошной слой (расслаивание). Процессу коацервации способствует низкая температура, изменения рН среды, введение низкомолекулярных электролитов. Наиболее изучена коацервация белков и полисахаридов в водных растворах. Коацервацию используют при микрокапсулировании лекарств. Застудневание. В результате ограниченного набухания ВМС или частичного испарения растворителя из раствора ВМС образуются студни. Таким образом, студень можно рассматривать как ограниченно набухший - полимер или концентрированный раствор полимера. Студни - это гомогенные системы. При старении гомогенность студней нарушается вследствие синерезиса - постепенного сжатия полимерной сетки (матрицы) и выделения кикой фазы. Синерезиз сопровождается уплотнением пространственной структуры-сетки и уменьшением объема студня. Пример синерезиса - отделение сыворотки при свертывании крови. Явление студнеобразования широко применяется при создании лекарственных препаратов - мазей и суппозиториев на соответствующих основах, депо лекарственных веществ, сорбентов, мембран с регулируемой скоростью высвобождения. Студни используют в процессе гельпроникающей хроматографии при разделении на группы суммарных (например, экстракционных) препаратов, а также для получения обессоленных препаратов, в том числе обессоленной воды. |
