Занятие 4 Мод1 Комплексные соединения. Комплексные соединения. Обоснование темы
 Скачать 138.81 Kb. Скачать 138.81 Kb.
|
|
Комплексные соединения . Обоснование темы. Комплексообразование имеет большое значение при протекании биологических процессов в живых организмах. Ионы щелочных и щелочно-земельных металлов в биологических жидкостях находятся в виде аквакомплексов, а ионы d-элементов, являясь прекрасными комплексообразователями, образуют комплексы, в которых в качестве лигандов выступают аминокислоты, нуклеиновые кислоты, витамины и гормоны. Например, железо входит в состав гемоглобина. Некоторые комплексные соединения обладают биологической активностью и применяются в качестве лекарственных препаратов (витамин В12). Кроме того, образование растворимых устойчивых комплексных соединений позволяет выводить из организма соли тяжелых металлов, что способствует дезинтоксикации организма. Комплексные соединения это молекулярные или ионные соединения, образующиеся путем присоединения к атому или иону металла или неметалла, нейтральных молекул или других ионов. Они способны существовать как в кристалле, так и в растворе. Основные положения и понятия координационной теории. Для объяснения строения и свойств комплексных соединений в 1893 г. швейцарским химиком А Вернером была предложена координационная теория в которую он ввел два понятия: о координации и о побочной валентности. По Вернеру главной валентностью называется валентность посредством которой соединяются атомы с образованием простых соединений, подчиняющихся теории валентности. Но, исчерпав главную валентность, атом способен, как правило, к дальнейшему присоединению за счет побочной валентности, в результате проявления которой и образуется комплексное соединение. Под действием сил главной и побочной валентности атомы стремятся равномерно окружить себя ионами или молекулами и являются таким образом центром притяжения. Такие атомы называются центральными или комплексообразователями. Ионы или молекулы, непосредственно связанные с комплексообразователем, называются лигандами. Посредством главной валентности присоединяются лиганды ионы, а посредством побочной валентности – ионы и молекулы. Притяжение лиганд к комплексообразователю называется координацией, а число лиганд – координационным числом комплексообразователя. Можно сказать, что комплексные соединения это соединения, молекулы которых состоят из центрального атома (или иона) непосредственно связанного с определённым числом других молекул или ионов, называемых лигандами. В роли комплексообразователей чаще всего выступают катионы металлов (Со+3, Рt+4, Cr+3, Cu+2Au+3 и др.) В качестве лигандов могут выступать ионы Cl-, CN-, NCS-, NO2-, OH-, SO42- так и нейтральные молекулы NH3, H2O, амины, аминокислоты, спирты, тиоспирты, РН3, эфиры. Число координационных мест, занимаемых лигандом около комплексообразователя, называется его координационной ёмкостью или дентатностью. Лиганды, присоединенные к комплексообразователю одной связью, занимают одно координационное месть и называются монодентатнымия (Cl-, CN-, NCS-). Если же лиганд присоединён к комплексообразователю посредством нескольких связей, то он является полидентатным. Например: SO42- , СО32-являются бидентатными. Комплексообразователь и лиганды составляют внутреннюю сферу соединения или комплекс (в формулах комплекс заключают в квадратные скобки). Ионы, не связанные непосредственно с комплексообразвателем, составляют внешнюю координационную сферу. Ионы внешней сферы связаны менее прочно по сравнению с лигандами и пространственно удалены от комплексообразователя. Они легко замещаются другими ионами в водных растворах. Например, в соединении К3[Fe(CN)6] комплексообразователем является Fe+2, лигандами - CN-. Два лиганда присоединены за счет главной валентности, а 4 – за счет побочной валентности, следовательно координационное число равно 6. Ион Fe+2 с лигандами CN- составляют внутреннюю сферу или комплекс, а ионы К+ внешнюю координационную сферу: 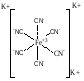 Как правило координационное число равно удвоенному заряду катиона металла, например: однозарядные катионы имеют координационное число равное 2, 2-х зарядные – 4, а 3-х зарядные – 6. если элемент проявляет переменную степень окисления, то с увеличением её координационное число растет. Для некоторых комплексообразователей координационное число является постоянным, например: Со+3, Рt+4, Cr+3 имеют координационное число равное 6, у ионов В+3, Ве+2, Сu+2 , Au+3 координационное число равно 4. для большинства ионов координационное число является переменным и зависит от природы ионов внешней сферы и от условий образования комплексов. Классификация и номенклатура комплексных соединений. Классификация комплексных соединений проводится по различным признакам.
катионные [Cu(NH3)4]2 анионные [Co(NO3)6]3- нейтральные [Pt(NH3)Cl2]0
акво- [Сu(H2O)4]SO4 аммино-[Cu(NH3)4]SO4 ацидо- К2[Cu(Cl)4] гидроксо-K2[Cu(OH)4] По структуре внутренней сферы различают внутрикомплексные(циклические) соединения. Например, в живом организме встречаются клешневидные (хелатные) пятичленные циклы. Они образуются катионом металла и ɑ-аминокислотами. К ним относятся гемоглобин, хлорофилл, витамин В12. При составлении названия комплексных соединений руководствуются следующими правилами:
Пример: катионные –[Cu(NH3)4 ]SO4 – тетраамминокупрат (II) сульфат; анионные – Na3[Co(NO2)6] –гексанитрокобольтат (III) натрия; нейтральные [Pt(NH3)]Cl2 - дихлородиамминоплатина. Комплексообразующая способность s-, р- и d- элементов Комплексообразующая способность катионов определяется следующими факторами: Заряд катиона, радиус катиона и электронная конфигурация катиона. Чем больше заряд катиона и меньше радиус, тем прочнее связь комплексообразователя с лигандами. Поэтому катионы s- элементов (К+, Nа+, Са+2, Мg+2 и др.) обладающие относительно большим радиусом и малым зарядом, имеют низкую комплексообразующую способность. Катионы d-элементов (Со+3, Рt+4, Сr+3и др.), имеющие, как правило небольшой радиус и высокий заряд, являются хорошими комплексообразователями. d-элементы имеют большое количество валентных орбиталей, среди которых имеются свободные орбитали и с неподелёнными электронными парами. Поэтому они одновременно могут быть и донорами и акцепторами. Если аналогичной возможностью обладает и лиганд, то одновременно с σ- связью (лиганд донор, а комплексообразователь является акцептором), образуюется и π-связь (лиганд акцептор, а комплексообразователь – донор). При этом происходит увеличение кратности связи, что обуславливает высокую прочность d- элементов со многими лигандами. Эта связь называется дативной связью. Характер химической связи в комплексных соединениях. Связь между комплексообразователем и лигандами осуществляется, посредством перекрывания электронных облаков. Связь, образованная по обменному механизму соответствует вернеровской главной валентности. Связь, образованная по донорно акцепторному механизму – побочной валентности; при этом лиганд является донором, а комплексообразователь акцептором. Связь по донорно – акцепторному механизму может возникнуть и между нейтральными молекулами, если одна имеет атом со свободной орбиталью, а другая не поделённую электронную пару. Следовательно: причина комплексообразования – валентная ненасыщенность атомов. Увеличение валентной насыщенности атомов в процессе комплексообразования ведёт к устойчивости комплексов. Поскольку комплексообразователь в большинстве случаев предоставляет для образования связей неравноценные орбитали, то происходит их гибридизация, а тип гибридизации определяет геометрию молекул. sp [KL2] линейная молекула [Ag(NH3)2]+ sp3 [KL4] тетраэдр или квадрат [Cu(H2O)4]2+ sр3d2 [Kl6] октаэдр хАу(СТ)6ъ2+ Внешнеорбитальные и внутриорбитальные комплексы Для катионов d- элементов характерны октаэдрические комплексы. При их образовании возможны два типа гибридизации: d2sр3 и sр3d2, в зависимости от того, какие d-орбитали комплексообразователя доступны для лиганд. Гибридизация d2sр3 осуществляется в том случае, если в образовании σ связей участвуют s и р орбитали внешнего уровня и две d-орбитали предпоследнего уровня. Этот вид гибридизации называется внутренней гибридизацией, а образующиеся комплексы внутриорбитальными. Например: [Cr(NH3)6]3+ Cr3+ 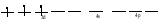  гибридизирующиеся орбитали гибридизирующиеся орбитали[Cr(NH3)6]3+ 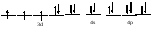  электронные пары от лигандов электронные пары от лигандовПри внутренней гибридизации лиганды прочно связаны с комплексообразователем, поэтому внутриорбитальные комплексы отличаются высокой устойчивостью. Если на образование σ-связей комплексообразователь поставляет только орбитали внешнего внешнего уровня, то осуществляется sр3d2 гибридизация. Её называют внешней, а образующиеся комплексы внешнеорбитальными. Такие комплексы образуют d-элементы с полностью заселёнными d подуровнями. Например: [Cd(Cl)6]4- Cd2+ 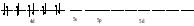  гибридизирующиеся орбитали гибридизирующиеся орбитали[Cu(Cl)6]4- 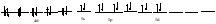  электронные пары от лигандов электронные пары от лигандовЭнергия связей, образованных при внешней гибридизации орбиталей комплексообразователя ниже, чем при внутренней гибридизации, поэтому внешнеорбитальные комплексы обладают меньшей прочностью по сравнению с внутриорбитальными. Если у катиона d- элемента d подуровень заселен неспаренными электронами, то тип гибридизации определяется природой лиганда. Лиганды, обладающие достаточной электронодонорной способностью, могут «вытеснить» электроны с двух орбиталей d подуровня и заставить их спариться на остальных двух орбиталях. При этом нарушается правило Гунда. Такой способностью обладают, например: цианид-ионы, поэтому они образуют внутриорбитальные комплексы. Например: [Fe(CN)6]4-: Fe2+ 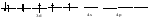 [Fe(CN)6]4- 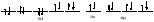 Если же лиганд не обладает достаточной электронодонорной способностью, то образуется внешнеорбитальный комплекс, например: [Fe(Н2О)6]2+ [Fe(Н2О)6]2+ 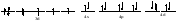 Число неспаренных электронов в процессе комплексообразования в этом случае не меняется. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины). Главную роль в жизнедеятельности живых организмов играют бионеорганические соединения с макроциклическими лигандами. В таких лигандах донорные атомы связаны в единое кольцо – цикл. Наиболее распространены тетрадентатные макроциклы – порфирины. Лигандами являются атомы азота, которые располагаются по углам квадрата и жестко скоординированы в пространстве. Поэтому они образуют прочные координационные соединения даже с катионами щелочно - земельных металлов. Например, если в качестве центрального атома выступает ион магния, то в результате образуется активный центр хлорофилла, а если используются ионы Fe2+, образуется активный центр гемоглобина. Порфириновые комплексы железа и кобальта входят в состав гемоглобина, каталазы, цитохромов, витамина В12. Все эти комплексы имеют октаэдрическую конфигурацию. Дефицит этих веществ в организме приводит к серьезным заболеваниям. Устойчивость комплексных соединений в растворах Ионы внешней сферы соединены с комплексом ионной связью, поэтому в водных растворах они легко отщепляются: [Fe(Н2О)6]SO4 ↔ SO42- + [Fe(Н2О)6]2+. Этот процесс называется первичной диссоциацией. Внутренняя сфера в зависимости от прочности также способна диссоциировать на комплексообразователь и лиганды: [Fe(Н2О)6]2+ ↔ Fe2+ + 6 Н2О – это вторичная диссоциация. Она аналогична диссоциации слабых электролитов и характеризуется константой равновесия: Крав. = 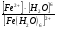 константа равновесия может служить мерой прочности комплекса: чем менее стоек комплекс, тем больше концентрация простых ионов или молекул Fe2+ и Н2О, тем больше численное значение константы. Поэтому константу равновесия, называют константой нестойкости комплекса. Величина, обратная константе нестойкости, называется константой устойчивости: Куст.= 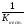 = =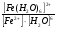 . .Механизм токсического действия тяжелых металлов. Всем известно, что загрязнение окружающей среды соединениями тяжелых металлов: ртути, свинца, кадмия, хрома, никеля и др. металлов – может привести к тяжелым отравлениям. Механизм токсического действия таких соединений объясняется взаимодействием катионов тяжелых металлов (Мт) с бионеорганическими комплексами. Это можно записать в виде реакции: МбL + Мт ↔ Мб + МтL Где МбL – комплекс иона биогенного металла Мб (Fe, Zn, Cu, Co) с биоорганическим лигандом L (например порфирином); Мт – ион тяжелого металла. Если устойчивость комплекса МтL больше, чем устойчивость МбL, происходит смещение равновесия вправо и в организме накапливаются соединения МтL, что приводит к нарушению нормальной работы организма. Значение комплексных соединений в медицине. Комплексообразование имеет большое значение для многих биологических процессов. В виде аквакомплексов находятся в крови, лимфе и тканевых жидкостях ионы щелочных и щелочноземельных металлов, выполняющих в организме важные и многообразные физиологические функции. Ионы d – элементов в результате высокой комплексообразующей способности находятся в организме исключительно в виде комплексов с белками и входят в состав гормонов, ферментов, витаминов и других жизненно важных соединений. Некоторые комплексные соединения обладают биологической активностью и применяются в качестве лекарственных препаратов - например витамин В12 , участвующий в процессах кроветворения, является комплексом кобальта. Токсические свойства некоторых веществ обусловлены их высокой комплексообразующей способностью. Например, токсическое действие на организм цианидов и оксида углерода объясняется их способностью образовывать прочные комплексы с катионами железа. Цианиды блокируют атомы железа, входящие в состав дыхательного фермента цитохромоксидазы, в результате прекращается клеточное дыхание. Оксид углерода (СО) связывает железо гемоглобина, вследствие этого гемоглобин утрачивает способность осуществлять транспорт кислорода. В медицинской практике при лечении многих заболеваний в качестве лекарственных препаратов используются соединения меди, серебра, цинка, кобальта, хрома, золота, платины, ртути и др. Вопросы для самоконтроля
Упражнения
Сr (III): а) [Cr(H2O)5Cl], б) [Cr(H2O)4Cl2 ], в) [Cr(H2O)2 (C2O4)2]. Дайте названия этих комплексных соединений.
к.ч.= 2, внешнюю сферу подберите сами. Дайте название этому КС; в) комплексообразователь Fe+2, лиганды СN, к.ч. = 6, внешнюю сферу подберите сами. Дайте название этому КС. Напишите для всех комплексов первичную и вторичную диссоциацию, покажите выражение константы нестойкости комплексов.
|
