конспект урока типы химических реакций. Конспект урока по теме «Типы химических реакций». Конспект урока по теме Типы химических реакций
 Скачать 56 Kb. Скачать 56 Kb.
|
|
Конспект урока по теме «Типы химических реакций» Тип урока: урок обобщения и систематизации знаний по теме. Форма урока: комбинированный урок с использованием ИКТ. Оборудование: учебник О.С. Габриеляна- 8 класс, малый химический тренажёр, интерактивная доска, мультимедиапроектор, презентация, реактивы и химическая посуда (растворы сульфата меди (II), гидроксида натрия, соляная (хлороводородная) кислота, цинк, бихромат аммония, 3 пробирки, штатив, спички, спиртовка, защитные очки, лучинка.) Цели урока: Закрепить понятие «химическая реакция», повторить признаки и условия протекания различных химических реакций. Обобщить знания о классификации химических реакций по составу и количеству исходных веществ и продуктов реакции. Продолжить формирование умения записывать уравнения химических реакций и определять их тип по составу и количеству исходных веществ и продуктов реакции. Задачи · Обучающие: - систематизировать знания учащихся о классификации веществ, типах химических реакций, продолжить формирование умений наблюдать, записывать уравнения и предвидеть продукты химических реакций, продолжить формирование умения при написании реакций обмена. · Развивающие:- совершенствовать умения школьников при составлении химических уравнений, при выполнении лабораторных опытов; совершенствовать умения учащихся сравнивать и обобщать; развивать память, устойчивое внимание, самостоятельное мышление, умение слушать и слышать другого человека; развивать аналитическое мышление. · Воспитательные:- продолжить формирование диалектико-материалистического мышления учащихся, умение наблюдать, формулировать выводы и обобщать информацию. Ход урока I. Все, что нас окружает, состоит из веществ. Кажется, что они живут своей жизнью, таинственной и непостижимой. Взаимодействуя, они изменяют свои свойства и состав. Без химических реакций невозможна жизнь и все многообразие веществ. И задача человека, изучив этот мир, постараться использовать полученные знания во благо. Сегодня на уроке мы должны систематизировать все полученные вами знания о химических реакциях, для того, чтобы в дальнейшем вы могли правильно описывать химические свойства веществ, а также предсказывать возможности их получения. Хорошо овладев этой темой, вы сможете решать всевозможные химические задачи. Слайд 1,2 Слайд 3: Вспомните, какие явления мы называем химическими реакциями? Учащиеся: Химические реакции - это явления, сопровождающиеся образованием новых веществ? По каким признакам можно определить, что у вещества изменились свойства? Учащиеся: Появление запаха, выделение газа, выпадение или растворение осадка, изменение цвета, выделение или поглощение тепла и света. Слайд 4: Проверим? Слайд 5: Реакции протекают повсюду: они происходят в окружающем нас воздухе, листьях растений, в организме человека. Например, в печени человека происходит 20 миллионов различных реакций. Слайд 6: Как с помощью химического языка описать происходящие явления? Учащиеся: С помощью химического уравнения. Химическое уравнение – это условная запись химической реакции с помощью химических формул и математических знаков. Слайд 7: Повторим правила составления химического уравнения. Учащиеся: Уравнения химических реакций составляют на основании Закона сохранения массы веществ. Число атомов химических элементов до реакции и после неё, остаётся неизменным, а значит, их общая масса тоже не изменяется. Огромное множество реакций необходимо классифицировать. Зачем? Учащиеся: Это необходимо сделать, чтобы не запутаться во всём многообразии химических реакций. Мы классифицировали реакции на 4 группы. Слайд 8: Какие типы реакций вы знаете? Учащиеся: Соединения, разложения, обмена, замещения. Слайд 9: Итак, По изменению числа исходных веществ и конечных продуктов реакции делят на Реакции соединения. Реакции разложения. Реакции замещения. Реакции обмена. Слайд 10: Рассмотрим примеры реакций соединения. Какие вещества взаимодействуют между собой? Какие вещества образуются? Что общего в этих реакциях? Какие реакции относятся к данному типу? Учащиеся:… Слайд 11 Вывод: Реакции между двумя или несколькими простыми или сложными веществами, в результате которых образуется только одно сложное вещество, называют реакциями соединения. Слайд 12: Рассмотрим примеры реакций разложения. Что общего в этих реакциях? Какие реакции относятся к данному типу? Учащиеся:… Слайд 13 Вывод: Реакции, в результате которых из одного сложного вещества получается несколько простых или сложных веществ, называют реакциями разложения. Слайд 14: Рассмотрим примеры реакций замещения. Назовите исходные вещества и продукты реакций, определите их состав. Выделите общие признаки этих реакций. Какие реакции относятся к данному типу? Учащиеся:… Слайд 15 Вывод: Реакции замещения -это реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе Слайд 16: Рассмотрим примеры реакций обмена. Какие реакции относятся к данному типу? Учащиеся:… Слайд 17 Вывод: Реакции обмена - это реакции, при которых два сложных вещества обмениваются своими составными частями. II. Работа с дидактическими материалами (см. приложение). Учащиеся выполняют задания по вариантам. Найдите такие реакции в своём варианте карты, объясните свой выбор: 1 вариант реакции соединения 2 вариант реакции разложения 3 вариант реакции замещения 4 вариант реакции обмена. Проверяем выполнение задания. Слайд 18,19. А теперь отдохнём. Выполним гимнастику для глаз. Внимательно следим глазами за движениями шайбы по экрану. Слайд 20 А теперь закрепление. Расставьте коэффициенты в следующих уравнениях реакций. Определите типы реакций, объясните свой выбор. 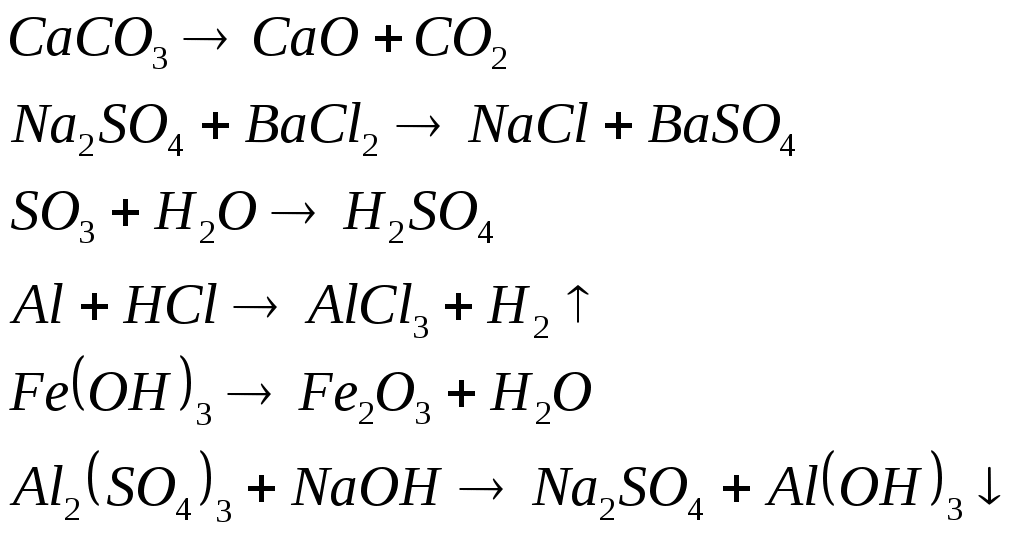 Слайд 21 Усложним задание. Напишите уравнения реакций по названиям исходных веществ и продуктов реакций. Определите типы реакций. а) Оксид натрия + оксид азота (V) → нитрат натрия б) Железо + соляная кислота → хлорид железа (II) + водород в) Хлорид калия + нитрат серебра → нитрат калия + хлорид серебра г) Железо + сера → сульфид железа (II) д) Сульфат магния + гидроксид натрия → гидроксид магния + сульфат натрия Итак, сегодня мы вспомнили всё, что знаем о химических реакциях. Использовали наши знания при выполнении заданий. Это поможет нам при изучении следующей темы. А теперь запишите домашнее задание: Слайд 23 Упражнение №3, стр. 145 Вам необходимо расставить коэффициенты в химических реакциях и определить их тип, то есть ещё раз повторить то, что мы делали на уроке. Для любителей решать задачи. Дополнительное задание: Упражнение №7, стр. 128 Вспомните, как решается задача с использованием понятия «массовая доля» Слайд 24. Урок окончен, спасибо за внимание. Приложения карточка — тренажер Уравнения химических реакций
|
