контрольная работа по химии. контр. работа по химии. Контрольная работа по дисциплине Химия вариант 7 ст гр. Этмз 21 Огнёв Н. С. Проверил Иванова Т. В. Чита, 2022
 Скачать 263 Kb. Скачать 263 Kb.
|
|
Федеральное государственное образовательное учреждение высшего образования «Забайкальский государственный университет» (ФГБОУ ВО «ЗабГУ») Факультет: Строительства и экологии Кафедра: Химии КОНТРОЛЬНАЯ РАБОТА по дисциплине: Химия вариант № 7 Выполнил: ст.гр. ЭТМз – 21 Огнёв Н.С. Проверил: Иванова Т.В. Чита, 2022 12. Напишите уравнения реакций Fе(ОН)3 с хлороводородной (соляной) кислотой, при которых образуются следующие соединения железа: а) хлорид дигидроксожелеза; б) дихлорид гидроксожелеза; в) трихлорид железа. Вычислите эквивалент и эквивалентную массу Fе(ОН)3 в каждой из этих реакций. Решение: Эквивалент вещества – количества вещества, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. Молярная масса эквивалентов (устаревшее название – эквивалентная масса) – масса одного моля эквивалентов вещества или элемента. Для нахождения молярной массы эквивалентов гидроксида железа (III) в реакциях нейтрализации необходимо молярную массу гидроксида железа (III) разделить на число моль атомов водорода, вступающих в реакцию. Молярная масса гидроксида железа (III) равна а) Один моль гидроксида железа (III) взаимодействует с 1 моль хлороводородной кислоты, эквивалентным 1 моль атомов водорода. Значит эквивалент гидроксида железа (III) в данной реакции Э(Fe(OH)3) = 1 моль Эквивалентная масса б) Один моль гидроксида железа (III) взаимодействует с 2 моль хлороводородной кислоты, эквивалентными 2 моль атомов водорода. Значит эквивалент гидроксида железа (III) в данной реакции Э(Fe(OH)3) = Эквивалентная масса в) Один моль гидроксида железа (III) взаимодействует с 3 моль хлороводородной кислоты, эквивалентными 3 моль атомов водорода. Значит эквивалент гидроксида железа (III) в данной реакции Э(Fe(OH)3) = Эквивалентная масса 30. Напишите электронные формулы атомов элементов с порядковыми номерами 14 и 40. Сколько свободных d-орбиталей у атомов последнего элемента? Решение: Электронная формула показывает количество электронов, находящихся на соответствующих орбиталях. Номер электронного уровня (соответствующий главному квантовому числу n) обозначают цифрами, после номера латинскими буквами s, p, d, fуказывают подуровень, справа вверху от каждой указывают общее число электронов на данном подуровне. Элемент с порядковым номером 14 – кремний Si. Электронная формула атома кремния имеет вид Элемент с порядковым номером 40 – цирконий Zr. Электронная формула атома циркония имеет вид В атоме циркония имеются 3 полностью свободные d-орбитали и 2 d-орби-тали заполненные наполовину. 59. Какую низшую и высшую степени окисления проявляют углерод, фосфор, сера и йод? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. Решение: Электронные конфигурации атомов углерода, фосфора, серы и йода имеют вид Валентные электроны подчеркнуты. Высшая степень окисления равна числу электронов, которые атом может предоставить для образования связей. Эти электроны называют валентными. Низшая степень окисления (с отрицательным знаком) равна числу электронов, которых атому не хватает до заполнения внешнего электронного слоя. На p-подуровне может максимально разместиться 6 электронов. Соответственно, высшие степени окисления: углерода +4 (CO2, оксид углерода (IV) ) фосфора +5 (H3PO4, ортофосфорная кислота) серы +6 (CaSO4, сульфат кальция) йода +7 (NaIO4, перйодат натрия) Низшая степень окисления элементов численно равна числу электронов, требующихся до заполнения внешнего электронного слоя (для данных элементов – разница между 8 и числом валентных электронов). Соответственно, низшие степени окисления данных элементов: углерода -4 (CH4, метан) фосфора -3 (PH3, фосфин) серы -2 (K2S, сульфид калия) йода -1 (HI, йодоводород) 71. Нарисуйте энергетическую схему образования молекулы Решение: Построим энергетическую схему для этих частиц по методу МО и определим порядок связи (ПС) 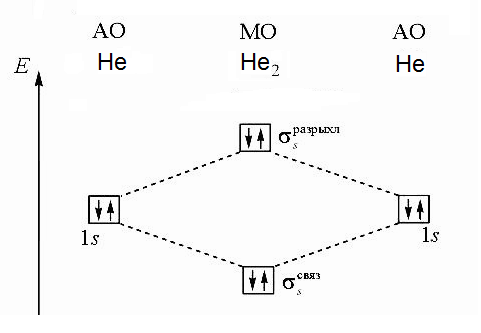 ПС = (2-2)/2 = 0 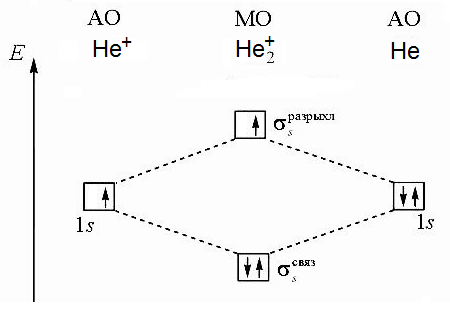 ПС = (2-1)/2 = 0,5 Из построенных энергетических схем видно, что в молекуле В молекулярном же ионе 91. Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж. Решение: Записываем уравнение реакции Согласно следствию из закона Гесса тепловой эффект химической реакции равен сумме изменений энтальпий продуктов реакции за вычетом суммы изменений энтальпий исходных веществ с учетом коэффициентов перед формулами веществ в уравнении реакции. Находим тепловой эффект реакции Отсюда, выделившееся количество теплоты равно: При сжигании 22,4 л С2Н2 выделяется 1255,6 кДж теплоты а при сжигании 165 л С2Н2 выделяется х кДж теплоты Составляем пропорцию: Отсюда, находим количество теплоты, выделившейся при сгорании 165 л. Ответ: 9248,8 кДж. 112. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ вычислите DGо298 реакции, протекающей по уравнению: СО2(г) + 4Н2(г) = СН4(г) + 2Н2О(ж) Возможна ли эта реакция при стандартных условиях? Ответ: -130,89 кДж. Решение: Величина G называется изобарно-изотермическим потенциалом или энергией Гиббса. Убыль энергии Гиббса (DG) является мерой химического сродства, зависит от природы вещества, его количества и от температуры. Самопроизвольно протекающие процессы идут в сторону уменьшения DG. Если DG < 0, процесс принципиально осуществим. Если DG > 0, процесс самопроизвольно проходить не может. Энтальпия (H) и энтропия (S) являются функциями состояния, то есть их изменения (DH, DS) являются разностью конечного и начального состояния системы. Находим изменение энтальпии и изменение энтропии данной реакции при стандартных условиях, используя табличные значения изменений энтальпий и абсолютных энтропий веществ. Поскольку Ответ: -130,89 кДж. 137. Константа равновесия гомогенной системы N2 + 3Н2 Ответ:[N2]р = 8 моль/л; [N2]исх = 8,04 моль/л. Решение: При равновесии скорости прямой и обратной реакций становятся равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы 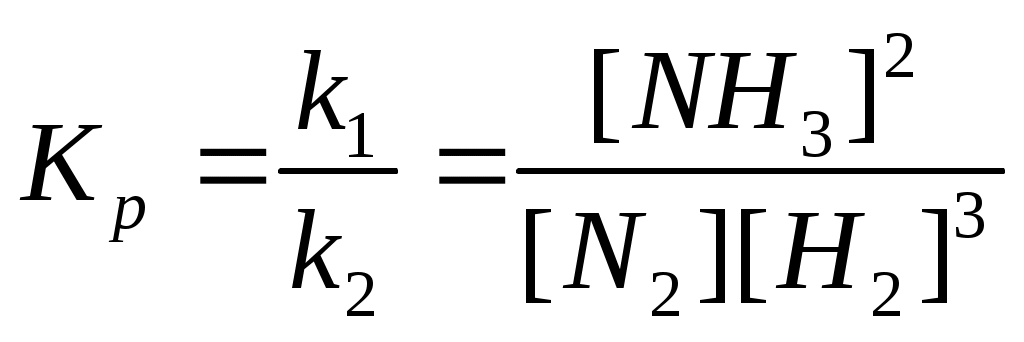 Находим равновесную концентрацию азота Согласно уравнению реакции при образовании 2 моль аммиака расходуется 1 моль азота. Находим исходную концентрацию азота 154. На нейтрализацию 1 л раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислите молярную концентрацию эквивалента раствора кислоты. Ответ: 0,5 н. Решение: Согласно закону эквивалентов: или Количество эквивалентов вещества равно отношению массы вещества к молярной массе эквивалентов вещества. В данном случае: Поскольку гидроксид калия – однокислотное основание, то молярная масса его эквивалентов численно равна его молярной массе. Находим молярную концентрацию эквивалентов кислоты 175. Вычислите процентную концентрацию водного раствора глюкозы C6H12O6, зная, что этот раствор кипит при 100,26°С. Эбуллиоскопическая константа воды 0,52°. Ответ: 8,25 %. Решение: По II закону Рауля повышение температуры кипения раствора где: 1 кг растворителя). Температура кипения чистой воды Находим моляльность раствора Молярная масса глюкозы имеет следующее значение М(С6Н12О6) = 180 г/моль Масса глюкозы в растворе Находим массовую долю глюкозы Ответ: 8,25 %. 197. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: a) H2SO4 и Ва(ОН)2; б) FеСl3 и NН4ОН; в) CH3COONa и HCl. Решение: а) Молекулярное уравнение Ионно-молекулярное уравнение б) Молекулярное уравнение Ионно-молекулярное уравнение в) Молекулярное уравнение Ионно-молекулярное уравнение 217. Составьте ионно-молекулярное и молекулярное уравнение гидролиза соли, раствор которой имеет: а) щелочную реакцию; б) кислую реакцию. Решение: Гидролизом называется обменная реакция вещества с водой. При этом происходит смещение равновесия диссоциации воды вследствие связывания одного из ионов (или обоих) с образованием мало-диссоциирующего или труднорастворимого вещества. Гидролизу подверга-ются соли, образованные либо слабой кислотой, либо слабым основанием, либо и тем и другим. Соли, образованные сильным основанием и слабой кислотой в водных растворах подвергаются гидролизу с накоплением ионов OH- (имеют щелочную реакцию среды) Соли, образованные слабым основанием и сильной кислотой в водных растворах подвергаются гидролизу с накоплением ионов Н+ (имеют кислую реакцию среды) а) Сульфид натрия образован сильным основанием и слабой кислотой. Гидролиз сульфида натрия обусловлен анионами Ионно-молекулярное уравнение гидролиза Молекулярное уравнение гидролиза б) Хлорид кобальта (II) образован слабым основанием и сильной кислотой. Гидролиз хлорида кобальта (II) происходит благодаря катионам Ионно-молекулярное уравнение гидролиза Молекулярное уравнение гидролиза |
