химия. конрольная по химии без титульника. Контрольная работа по химии Вычислить стандартную энтальпию образования Ag2c реакция протекает по уравнению Ag2O(кр) со2(г) Ag2CO3(кр) 343,83 кДж
 Скачать 91.44 Kb. Скачать 91.44 Kb.
|
|
Контрольная работа по химии 1.Вычислить стандартную энтальпию образования Ag2CO3. Реакция протекает по уравнению: Ag2O(кр) + СО2(г) = Ag2CO3(кр) - 343,83 кДж. 2.Эндотермическая реакция протекает по уравнению: СН4(г) + СО2(г) → 2СО(г) + 2Н2(г). При какой температуре начнется эта реакция? 3.Вычислить массу ортофосфорной кислоты в 500 мл 60% раствора r = 1,1 г/мл. 4.Сколько граммов сахара С12Н22О11 нужно растворить в 100 г воды, чтобы понизить температуру замерзания раствора на 12 °С? 5. Закончить уравнение реакции: CaCl2 + H3PO4 ®. Написать ионное уравнение. 6. Вычислить электродный потенциал SnïSnCl2 при концентрации ионов [Sn2+] = = 0,0001 моль/л. 7. Вычислить ЭДС элемента, составленного из цинковых электродов при концентрации ионов [Zn2+] = 0,1 моль/л, [Zn2+] = 0,001 моль/л. Рассчитать DG и указать возможность работы элемента. 8. Составить схему электролиза раствора и расплава MnCl2. 9. Какие процессы пойдут на электродах гальванического элемента, работающего на воздухе при коррозии омедненного железа? 10. Составить электронную формулу марганца. Определить валентность и степень окисления. На основании валентности составить формулы оксидов и гидроксидов Mn. Определить их кислотно – основной характер. 11. Дать характеристику химического элемента № 36 Задание 1 Решение: По справочным данным находим стандартные значения энтальпий образования для каждого вещества:
Н0реакции рассчитывают по следствию из закона Гесса: ΔH0реакции = ΣΔf H0кон•n – ΣΔf H0нач•n n – количество вещества Находим количество вещества этанола: Нреакции = (ΔH0 (Ag2CО3)•n (Ag2CО3) – (-393,51 кДж/моль•1 моль + (-30,56 кДж/моль•1 моль), тогда ΔH0 (Ag2CО3)•n (Ag2CО3) = - 343,83 кДж + (-393,51 кДж/моль•1 моль + (-30,56 кДж/моль•1 моль) = -767,9 кДж ΔH°298К (Ag2CО3) = -767,9 кДж/ n(Ag2CО3) = -767,9 кДж/1 моль = -767,9 кДж/моль Ответ: ΔH°298К (Ag2CО3) = -767,9 кДж/моль Задание 2 Решение: По табличным данным находим стандартные значения энтальпий образования и энтропий для приведённых веществ
Находим ΔH°реакции и ΔS°реакции по следствию из закона Гесса По следствию из закона Гесса «тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ» находим теплоты образования каждого из веществ. ΔH°реакции = ΣΔH°298К•n (продуктов реакции) — ΣΔH°298К•n (исходных веществ), где ΔH°298К – стандартная теплота образования вещества; n – количество вещества (условно считаем по коэффициентам реакции) ΔS°реакции = ΣΔS°298К•n (продуктов реакции) — ΣΔS°298К•n (исходных веществ), где ΔS°298К – стандартная теплота образования вещества; n – количество вещества (условно считаем по коэффициентам реакции) ΔH°реакции 298К = (ΔH°298К (СО)•n(СО) + ΔH°298К (Н2)•n(Н2)) – (ΔH°298К (СН4)•n(СН4) + ΔH°298К (СО2)•n(СО2)) = (-110,5 кДж/моль•2моль + (0 кДж/моль•2моль) – (-74,8 кДж/моль•1моль + (-393,5 кДж/моль•1моль )) = 247,3 КДж ΔS°реакции 298К = (ΔS°298К (СО)•n(СО) + ΔS°298К (Н2)•n(Н2)) – (ΔS°298К (СН4)•n(СН4) + ΔS°298К (Н2О)•n(Н2О)) = (197,91 Дж/моль•К•2моль + 130,59 Дж/моль•К•2моль) – (213,65 Дж/моль•К•1моль + 186,19 Дж/моль•К•1моль = 257,16 Дж/К = 0,25716 кДж/К ΔG°реакции 298К = ΔH°реакции 298К - T•ΔS°реакции 298К Равновесие в системе наступает, когда ΔG°реакции 298К = 0, тогда ΔH°реакции 298К = T•ΔS°реакции 298К, тогда Т = ΔH°реакции 298К/ ΔS°реакции 298К = 247,3 кДж/0,25716 кДж = 961,7К Ответ: Т = 961,7К Задание 3 Решение: Находим массу раствора m раствора = V (раствора)•ρ = 500 мл•1,1 г/мл = 550 г Находим массу Н3РО4в растворе m (Н3РО4) = m (раствора)•ω (Н3РО4)/100% = 550 г•60%/100% = 330 г Ответ: m (NaOH) = 330 г Задание 4 Решение: Находим массу сахара исходя из закона Рауля: 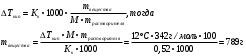 Кк – криоскопическая постоянная воды (равна 0,52) Ответ: m (C12Н22O11) = 789 г Задание 5 . Решение: 3CaCl2 + 2Н3PO4 = 6НCl + Ca3(PO4)2↓ 3Ca2+ + 6Cl- + 2Н3PO4 = 6Н+ + 6Cl- + Ca3(PO4)2↓ 3Ca2+ + 2Н3PO4 = 6Н+ + Ca3(PO4)2↓ Задание 6 Решение: Находим стандартный электродный потенциал олова φo Cd/Cd2+ = -0,403 В Находим потенциал электрода по уравнению Нернста φкатода = φo Cd/Cd2+ + 0,059/2•lg[Sn2+] = -0,403В + 0,059/2•lg0,0001 моль/л = -0,522В Задание 7 Решение: Находим стандартный электродный потенциал цинка φо (Zn2+/Zn) = − 0,76 B Гальванический элемент может быть составлен не только из различных, но и одинаковых электродов, погруженных в растворы одного и того же электролита различной концентрации (концентрационные элементы). Металл, погруженный в электролит с меньшей концентрацией будет являться анодом, металл, погруженный в электролит с большей концентрацией будет являться катодом. Электродные потенциалы электродов по уравнению Нернста φ (катода) = φо (Zn2+/Zn) + 0,059/2•lg[Zn2+] = − 0,76 B + 0,059/2•lg 0,1 моль/л = -0,79В φ (анода) = φо (Zn2+/Zn) + 0,059/2•lg[Zn2+] = − 0,76 B + 0,059/2•lg 0,001 моль/л = -0,85В Находим ЭДС гальванического элемента Е = Е (катода) – Е (анода) = -0,79В – (-0,85)В = 0,06В Ответ: Е = 0,054В Задание 8 Решение: Электролиз расплава МnСl2 MnCl2 → Mn2+ + 2Cl- Катод (С): Mn2+ +2е- → Mn Анод (+): 2Cl- -2e- → Cl2 Электролиз раствора МnСl2 Катод (С) Mn2+ +2е- → Mn Анод (С) 2H2O -4е- → O2 + 4H+ Задание 9 Решение: Стандартные электродные потенциалы у железа и меди равны φ0Fe/Fe2+ = - 0,44 В φ 0Cu/Cu+ = + 0,338 В φ 0Fe/Fe2+ < φ 0Cu/Cu+, поэтому медь будет являться катодом, а железо – анодом. Во влажном воздухе при нарушении целостности покрытия будут происходить следующие процессы: анод будет разрушаться, на катоде будет происходить выделение гидроксид-ионов. В результате будет образовываться ржавчина Анод (Fe): Fe -2e- → Fe2+ Катод (Cu): 2H2O + O2 +4e- → 4OH- Суммарный процесс: 2Fe + 2H2O + O2 → 2Fe(OH)2 Задание 10 Решение: Электронная формула атома марганца в основном состоянии 25Mn – 1s2 2s2 2p6 3s2 3p6 4s2 3d5 3d 4s 4p 4d 4f                             25 Mn -… 25 Mn -… Электронная формула атома марганца в возбуждённом состоянии 25Mn* – 1s2 2s2 2p6 3s2 3p6 4s13d54р1 3d 4s 4p 4d 4f                             25 Mn* -… 25 Mn* -… Валентность марганца в нормальном состоянии равна 5. Такая валентность обусловлена пятью неспаренными (валентными) электронами на 3d-подуровне, но вакантные орбитали на 4p-подуровне вносят дополнительный вклад в валентность, в возбуждённом состоянии электроны на s-подуровне распариваются и марганец в некоторых соединениях проявляет валентность, равную 7. Степени окисления марганца:
C возрастанием степени окисления свойства оксидов и гидроксидов марганца меняются от основного к кислотным. Чем выше степень окисления марганца, тем увеличиваются кислотные свойства. Чем выше степень окисления, тем более ковалентные соответствующие соединения, тем выше кислотные свойства. Задание 11 Решение: Элемент под номером 36 – криптон. Относительная атомная масса равна 84 а.е.м, Порядковый номер – 36. Строение атома: а) Заряд ядра атома - +36, имеется 36 протонов и (84-36) = 48 нейтронов б) Всего криптон имеет 36 электронов в) Электронная формула: 36Кr – 1s22s22p63s23p64s23d103p6 г) Валентные электроны - 4s23d6 Криптон находится в 4 периоде периодической системы Д.И. Менделеева, в VIII группе, побочной подгруппе, является р-элементом. Так как криптон находится в 4 периоде, то главное квантовое число равно 4, так как находится в VIII группе, то на внешнем энергетической уровне имеется 8 валентных электронов Так как криптон является р-элементом, то проявляет неметаллические свойства. Валентные возможности криптона: VIII Криптон химически инертен Получается как побочный продукт в виде криптоно-ксеноновой смеси в процессе разделения воздуха на промышленных установках. Применение: - Производство сверхмощных эксимерных лазеров (Kr-F). - Криптон используется для заполнения ламп накаливания, увеличивая срок службы нити накала. - Как теплоизолятор и шумоизолятор в стеклопакетах. - Рабочее тело для электроракетных двигателей. |

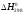 , кДж/моль
, кДж/моль