Культуральные свойства бактерий на плотных питательных средах
 Скачать 127 Kb. Скачать 127 Kb.
|
|
КУЛЬТУРАЛЬНЫЕ СВОЙСТВА БАКТЕРИЙ НА ПЛОТНЫХ И В ЖИДКИХ ПИТАТЕЛЬНЫХ СРЕДАХ. ФЕРМЕНТАТИВНЫЕ (БИОХИМИЧЕСКИЕ) СВОЙСТВА БАКТЕРИЙ. ИЗУЧЕНИЕ ВОЗДЕЙСТВИЯ НА КУЛЬТУРЫ БАКТЕРИИ И ГРИБОВ ФИЗИЧЕСКИХ И ХИМИЧЕСКИХ ФАКТОРОВ, УЛЬТРАФИОЛЕТОВОГО ИЗЛУЧЕНИЯ КУЛЬТУРАЛЬНЫЕ СВОЙСТВА БАКТЕРИЙ НА ПЛОТНЫХ ПИТАТЕЛЬНЫХ СРЕДАХ На этих средах бактерии растут в виде колоний, которые подвергают изучению (см. рис. 33). 1. Макроскопическое изучение колоний в проходящем свете проводится невооруженным глазом. Чашку поворачивают дном к себе на расстоянии лучшей видимости. При наличии двух различных видов колоний их нумеруют и описывают каждую в отдельности. В протоколе отмечают следующие данные: • величина колоний (крупная — 4-5 мм в диаметре и более, средняя — 2-4 мм, мелкая —1-2 мм, карликовая — не более 1 мм); » форма очертаний колоний (правильно и неправильно округлая, розеткообразная, ризоидная и др.); в степень прозрачности (плотная — непрозрачная, полупрозрачная, прозрачная). 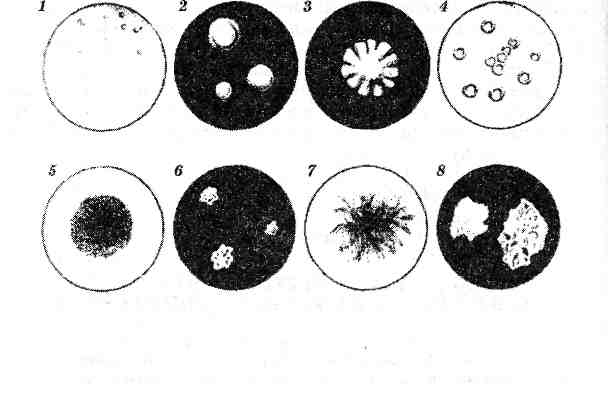 Рис. 33 Культуралъные свойства бактерий на плотных питательных средах: 1 — круглые с ровными краями; 2— круглые, выпуклые, блестящие, слизистой консистенции; 3 — с неровными краями; 4 — круглые с валиком по периферии; 5 — зернистые; в — плоские листовидные; 7 — ветвистые; S — складчатые. В отраженном свете рассматривают колонии со стороны крышки, не открывая ее, и отмечают: цвет колоний (бесцветная, пигментированная, цвет пигмента); поверхность (гладкая, блестящая, влажная или морщинистая, матовая, сухая и др.); положение колонии на питательной среде (возвышающаяся над средой, погруженная в среду, на уровне среды — плоская, плотно прилегающая к среде — уплощенная). 2. Микроскопическое изучение колоний. Чашку устанавливают вверх дном на предметном столике микроскопа, опускают конденсор и объективом х8 изучают структуру и края колоний: характер краев (ровные, волнистые, зазубренные, бахромчатые и др.); в структура колоний (гомогенная, аморфная, зернистая, волокнистая и др.). КУЛЬТУРАЛЬНЫЕ СВОЙСТВА БАКТЕРИЙ В ЖИДКИХ ПИТАТЕЛЬНЫХ СРЕДАХ Рост бактерий в жидких питательных средах характеризуется следующими признаками. Не встряхивая содержимое пробирки с посевом, вначале обращают внимание на поверхностный рост, который может быть в виде пристеночного кольца или пленки по всей поверхности среды. По своему характеру пленка может быть нежная или грубая, складчатая или ровная; по консистенции — хрупкая, слизистая, сальная. Отмечают также характер и степень помутнения среды, которое может быть незначительное (в виде опалесценции), слабое, умеренное и интенсивное. Многие бактерии на жидких питательных средах образуют на дне пробирки осадок, который выявляется при легком встряхивании пробирки. Он может быть незначительным или обильным, зернистым, хлопьевидным, слизистым, крошковидным и т. д. Ряд бактерий образует водорастворимые пигменты, которые равномерно окрашивают питательную среду в сине-зеленый, ярко-красный и желтый цвета. После изучения культуральных свойств выделяемых бактерий на плотной питательной среде из отдельной колонии готовят мазок и окрашивают по Граму. Проводят микроскопию. Из этой же колонии делают пересев на скошенный МПА и МПБ для выделения чистой культуры бактерий (2-й день исследования). ФЕРМЕНТАТИВНЫЕ (БИОХИМИЧЕСКИЕ) СВОЙСТВА БАКТЕРИЙ В зависимости от субстрата, который расщепляет бактерии, ферментативные свойства условно подразделяются на: сахаролитические, протеолитические, гемолитические, восстанавливающие свойства, каталазную активность и др. ОПРЕДЕЛЕНИЕ ФЕРМЕНТАЦИИ УГЛЕВОДОВ Для такого определения чистую культуру бактерий засевают на дифференциально-диагностические среды, в состав которых входят различные углеводы и индикаторы. В зависимости от изучаемого рода и вида бактерий избирают среды с соответствующими моно- и дисахаридами (глюкоза, лактоза, мальтоза, сахароза и др.), полисахаридами (крахмал, гликоген, инсулин и др.), высшими спиртами (глицерин, маннит и др.). В процессе ферментации бактерии образуют конечные продукты: альдегиды, кислоты и газообразные продукты (С02, Н2, СН4). Для определения ферментативных свойств используют питательные среды: полужидкие с индикатором ВР, жидкие (среда Гисса) и плотные (среды Эндо, Левина, Дригаль-скогоидр.). В полужидкие среды с индикатором ВР посев производится петлей, опущенной до дна пробирки. В результате ферментации углеводов индикатор изменяет свою окраску, а пузырьки газа распределяются в питательной среде и в связи с ее вязкостью могут некоторое время сохраняться в среде. - В  жидких питательных средах изменения устанавливают также по изменению цвета индикатора, а образование газа — с помощью «поплавка» (небольшая пробирка помещается вверх дном), в котором появляется пузырек газа. жидких питательных средах изменения устанавливают также по изменению цвета индикатора, а образование газа — с помощью «поплавка» (небольшая пробирка помещается вверх дном), в котором появляется пузырек газа.При отсутствии ферментации цвет среды не меняется. Поскольку бактерии ферментируют не все, а только некоторые углеводы, входящие в состав сред Гисса, то наблюдается довольно пестрая картина. Поэтому набор сред с углеводами и цветным индикатором был назван «пестрым» рядом (см. рис. 34). Для разовой дифференциации микроорганизмов семейства энтеробактерий широко используется их способность расщеплять различные углеводы с образованием кислоты и газа. На плотных дифференциально-диагностических средах, в состав которых входят углеводы и индикатор, вырастают колонии, имеющие различную окраску. Например, кишечная палочка, ферментирующая лактозу, на среде Эндо образует ярко-красные колонии; сальмонеллы, не ферментирующие лактозу, на этой среде образуют бесцветные или слегка розоватые колонии. ОПРЕДЕЛЕНИЕ ПРОТЕОЛИТИЧЕСКИХ СВОЙСТВ 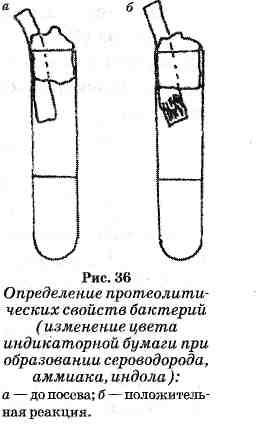 Наиболее часто для обнаружения протеолитических ферментов производят посев чистой культуры бактерий уколом в столбик мясопептонного желатина. Посевы выдерживают при комнатной температуре (20-22°С) в течение нескольких дней, при этом регистрируют не только наличие разжижения, но и его характер. Наиболее часто для обнаружения протеолитических ферментов производят посев чистой культуры бактерий уколом в столбик мясопептонного желатина. Посевы выдерживают при комнатной температуре (20-22°С) в течение нескольких дней, при этом регистрируют не только наличие разжижения, но и его характер.Разжижение может быть послойное, что характерно для синегнойных бактерий, в виде «чулка» — стафилококки. Характер разжижения желатина возбудителем сибирской язвы напоминает перевернутую елочку (рис. 35). Протеолитическое действие микроорганизмов можно наблюдать при посевах на свернутую сыворотку крови, вокруг колоний появляются углубления и зоны разжижения. В молоке наблюдается просветление или растворение образовавшегося вначале сгустка казеина, который расщепляется с образованием пептона, что придает молоку желтоватый цвет (пептонизация молока). Показателями более глубокого расщепления белка являются его конечные продукты: индол, аммиак, сероводород и др. Для определения этих газообразных веществ производят посев чистой культуры бактерий в бульон или пептон-ную воду. В пробирки с засеянной средой между стенкой пробирки и пробкой помещают индикаторную бумагу (рис. 36). Посевы выращивают в термостате в течение 1-3 суток. Обнаружение индола проводится несколькими методами. Наиболее прост и доступен способ Мореля. Узкие полоски фильтровальной бумаги смачивают горячим насыщенным раствором щавелевой кислоты (индикаторная бумага) и высушивают. При выделении индола на 1-3-й день нижняя часть полоски бумаги вследствие соединения индола со щавелевой кислотой приобретает розовый цвет. Обнаружение аммиака определяют по посинению розовой лакмусовой бумаги, помещенной в пробирку таким же образом, как и для определения индола. Обнаружение сероводорода. В пробирку с посевом помещают индикаторную полоску фильтровальной бумаги, смоченную раствором уксуснокислого свинца. При взаимодействии сероводорода и уксуснокислого свинца бумага чернеет за счет образования сернистого свинца. ОПРЕДЕЛЕНИЕ РЕДУЦИРУЮЩЕЙ (ВОССТАНАВЛИВАЮЩЕЙ) СПОСОБНОСТИ Для этой цели используют метиленовую синь, тионин, лакмус, нейтральный красный и др. К МПА и МПБ прибавляют раствор одного из указанных красителей. При наличии у бактерий редуцирующей способности среда обесцвечивается. Наиболее широкое применение имеет среда Ротбергера (МПА с 1 % глюкозы и несколькими каплями насыщенного раствора нейтрального красного). При положительной реакции красный цвет среды переходит в желтый. ОПРЕДЕЛЕНИЕ ФЕРМЕНТА КАТАЛАЗЫ Каталаза разлагает перекись водорода на воду и молекулярный кислород. Для обнаружения каталазы на поверхность 24-часовой культуры на скошенном МПА наливают 1-2 мл 1%-ного раствора перекиси водорода. Появление пузырьков газа при наклонном положении пробирки регистрируется как положительная реакция. В качестве контроля следует параллельно исследовать культуру, заведомо содержащую каталазу. ОПРЕДЕЛЕНИЕ ПЛАЗМОКОАГУЛЯЦИИ Является одной из наиболее надежных проб для выявления патогенности стафилококков. Для ее постановки разливают по 1-2 мл стерильной плазмы, вносят бактериологической петлей культуру бактерии и помещают в термостат. Проверяют результаты через 30 мин, 2 и 4 ч и на другой день. При положительной реакции происходит коагуляция (свертывание плазмы). ОПРЕДЕЛЕНИЕ ДНК-АЗЫ К расплавленному МПА добавляют навеску ДНК из расчета 2 мг на 1 мл среды. Посевы проводят в виде полоски и помещают в термостат на 18-24 ч. На выросший стафилококк наливают 5-6 мл н. НС1. Присутствие в культуре фермента, расщепляющего ДНК, выявляется образованием прозрачных зон вокруг колоний стафилококка. ОПРЕДЕЛЕНИЕ ГЕМОЛИТИЧЕСКОЙ СПОСОБНОСТИ Исследуемую культуру засевают на поверхность кровяного МПА. Для приготовления этой среды к 2% -ному расплавленному и охлажденному до 45°С МПА вносят 5% дефибринированной крови лошади, барана или кролика. Культивирование проводится при 37°С в течение 24-48 ч. Вокруг колоний микробов, вырабатывающих гемолизин, образуются зоны просветления вследствие растворения эритроцитов. Различают а-гемолиз, когда колонии окружены зоной, окрашенной в зеленый цвет, и р-гемолиз при бесцветной зоне. ИЗУЧЕНИЕ ВОЗДЕЙСТВИЯ НА КУЛЬТУРЫ БАКТЕРИИ И ГРИБОВ ФИЗИЧЕСКИХ И ХИМИЧЕСКИХ ФАКТОРОВ, УЛЬТРАФИОЛЕТОВОГО ИЗЛУЧЕНИЯ ФИЗИЧЕСКИЕ ФАКТОРЫ К числу основных физических факторов, воздействующих на микроорганизмы как в естественной среде обитания, так и в искусственных данных условиях лаборатории, относятся температура, свет, электричество, высушивание, различные виды излучения, осмотическое давление и др. Температура. О влиянии температуры на микроорганизмы обычно судят по их способности расти и размножаться в определенных температурных границах. Для каждого вида бактерий определена оптимальная температура развития. В зависимости от пределов этой температуры бактерии разделены на следующие три физиологические группы: псих-рофильные, мезофильные и термофильные. Психрофилъныё микроорганизмы (психрофилы) — преимущественно обитатели северных морей, почвы, сточных вод (светящиеся бактерии, некоторые железобактерии и др.). Температурные границы психрофилов: температура минимум около 0°С, оптимум — 15-20°С, максимум — 30-35°С. Мезофильные бактерии — наиболее обширная группа. Сюда относятся большинство сапрофитов и все патогенные микроорганизмы. Температурный минимум — 10°С, оптимум — 30-37°С, максимум — 40-45°С. Термофильнье бактерии часто и в большом количестве встречаются в природе: почве, воде, теплых минеральных источниках, а также в пищеварительном тракте животных и человека. Температурный минимум — 35°С, оптимум — 50-60°С, максимум — 70-75°С. Способность некоторых неспорообразующих бактерий существовать в горячих источниках при температурах 40-93°С и выше послужила основанием для выделения этих организмов в новую группу экстремально-термофильных бактерий. Возможность существования термофилов при высокой температуре обусловлена особым составом липидных компонентов клеточных мембран, высокой термостабильностью белков и ферментов, а также клеточных ультраструктур. Высокие и низкие температуры по-разному влияют на микробы. При низких температурах микробная клетка переходит в состояние анабиоза, в котором она может существовать длительное время. Так, эшерихии сохраняют жизнеспособность при 190°С до 4 месяцев, холерный вибрион — при 45°С до 2 месяцев, возбудитель листериоза — при 10°С до 3 лет. Низкие температуры приостанавливают гнилостные и бродильные процессы. На этом принципе основано сохранение продуктов в ледниках, погребах и холодильниках. В микробиологической практике широко применяется длительное хранение культур микробов, иммунноглобулинов, антибиотиков, живых вакцин в высушенном виде из замороженного состояния. Метод получения сухих культур микроорганизмов путем высушивания из замороженного состояния (-76°С) под высоким вакуумом называется лиофили-зацией. При лиофилизации свободная вода и вода, непрочно связанная с гидрофильными веществами клеток, подвергается замораживанию, и затем происходит сублимация льда, т. е. переход его из твердого состояния в парообразное, минуя жидкую фазу. После этого остается сухая пористая масса, которая при добавлении к ней воды легко суспендируется. Повторное замораживание и оттаивание неблагоприятно воздействуют на микроорганизмы и могут стать причиной их гибели при лиофилизации. Высокая температура, в особенности нагревание паром под давлением, губительно действует на микробы. Чем выше максимальная температура, тем быстрее погибают вегетативные формы микроорганизмов: при 60°G — через 30 мин, при 70°С — через 10-15, при 80-100рС — через 1 мин. В основе бактерицидного действия высоких температур лежит разрушение ферментов каталазы, оксидаз, дегидраз за счет денатурации (свертывание) белков и нарушения осмотического барьера. Споры бактерий более устойчивы к действию высокой температуры. Воздействие высокой температурой является самым распространенным, удобным и надежным способом стерилизации (обеспложивания), уничтожения различных микробов и их спор в разнообразных объектах. Существуют разные способы стерилизации: прокаливание на огне; кипячение; стерилизация сухим паром в печах Пастера (сухожаро-вые шкафы); стерилизация паром под давлением в автоклавах; без давления в аппарате Коха; тиндализация (дробная стерилизация при 56-58°С); пастеризация — метод, предложенный Пастером с целью сохранения питательной ценности молока, вина, различных консервов, которые постепенно нагревают до 80°С на 30 мин, а затем быстро охлаждают до 4-8°С. При пастеризации погибают вегетативные формы микробов, споры же сохраняются, но быстрое охлаждение и хранение продукта при 4-5°С препятствует их прорастанию и последующему размножению микробов. Стерилизации подвергают перевязочный материал, хирургический инструмент, различные растворы. Система мер, полностью предотвращающих проникновение микроорганизмов в макроорганизм при ранении, хирургических вмешательствах, называется асептикой. Уничтожение микроорганизмов в ранах при помощи химических средств (растворы хлора, йода, пероксид водорода, калия перман-ганата, этакридина лактата, метиленового синего, бриллиантового зеленого, азотнокислого серебра и др.) называется антисептикой (от греч. anti — против, septikos — гнилостный). Ультрафиолетовое излучение. Ультрафиолетовое излучение (УФИ) с длиной волн 300-400 нм является химически активным, 295-330 нм — биологически активным, а 200-295 нм — бактерицидно активным. Механизм действия УФИ заключается в том, что в цепях ДНК между остатками тими-на образуются ковалентные связи, что приводит к частичному или полному подавлению репликации ДНК, а также повреждению рибонуклеиновых кислот (особенно мРНК). При облучении микробов УФИ с длиной волны 320-400 нм возможна фотореактивация, т. е. восстановление жизнеспособности микроорганизмов. УФИ широко применяют для санации воздуха в животноводческих помещениях, в лабораториях и промышленных цехах (бродильная промышленность, производство антибиотиков), в боксах для создания асептических условий. Для дезинфекции воздуха предназначены лампы низкого давления, типа БУВ-15, БУВ-30, БУВ-30П, БУВ-60П и ДБ-60. На основе использования ультрафиолетовых и инфракрасных ламп для животноводческой практики применяют установку ИКУФ-1. Промышленностью выпускаются также бактерицидные облучатели с одной или двумя лампами БУВ-30 или БУВ-60П, последние широко применяются в животноводстве и птицеводстве для дезинфекции воздуха помещений. ХИМИЧЕСКИЕ ФАКТОРЫ Химические вещества могут тормозить или полностью подавлять рост микроорганизмов. Если химическое вещество подавляет рост бактерий, но после устранения его воздействия их рост возобновляется, то это явление называют бактериостаз (бактериостатическое действие), т. е. происходит задержка роста микроба, а не его гибель. При бактерицидном действии химический агент вызывает гибель клеток. Бактерицидное действие химических веществ имеет огромное значение, и его учитывают при использовании химического вещества в качестве дезинфектанта. Эффективность дезинфицирующих средств зависит от многих факторов: биологических особенностей микроорганизмов, концентрации раствора, экспозиции, температуры и окружающей среды. Противомикробные вещества по химическому строению и механизму бактерицидного действия можно подразделить на следующие группы: окислители, галогены, соединения металлов, кислоты и щелочи, поверхностно-активные вещества, спирты, красители, производные фенола и формальдегида. Окислители. К этой группе принадлежат перекись водорода и перманганат калия. Эти соединения, выделяя активный атомарный кислород, вызывают цепную реакцию свободно-радикального перекисного окисления липидов, что ведет к деструкции мембран и белков микроорганизмов. Галогены. Это хлор, йод и их препараты: хлорная известь', хлорамин Б, раствор йода спиртовой 5%-ный, йодинол, йодоформ. Их бактерицидное действие связано со способностью отщеплять активные галогены — хлор и йод, которые, замещая водородные атомы у атомов азота, денатурируют белки цитоплазмы микроорганизмов, а также, выделяя атомарный кислород, оказывают значительное окисляющее действие. Соединения тяжелых металлов. Это соли свинца, меди, цинка, серебра, ртути; металлоорганические соединения серебра: протаргол, колларгол. Они оказывают противомик-робное действие. В зависимости от концентрации и свойств катиона они вызывают местный вяжущий, раздражающий и прожигающий эффекты на ткани микроорганизма. Антимикробное действие соединений тяжелых металлов обусловлено ослаблением активности ферментов, содержащих сульфгидрильные группы, а также образованием с белками альбуминатов: R-COOH + AgN03 -> R-COOAg + HN03. Посеребренные предметы, посеребренный песок при контакте с водой придают ей бактерицидные свойства по отношению ко многим видам бактерий. Механизм бактерицидного действия заключается в том, что положительно заряженные ионы металлов адсорбируются на отрицательно заряженной поверхности бактерий и изменяют проницаемость их цитоплазматической мембраны, в результате чего происходит гибель микробной клетки. Кислоты и щелочи. В основе бактерицидного действия кислот и щелочей лежат дегидратация микроорганизмов, изменение рН питательной среды, гидролиз коллоидных систем и образование кислотных и щелочных альбуминатов. Кислоты в концентрированных растворах коагулируют белки микробной клетки, изменяют концентрацию Н-ионов в растворах и окисляющее действие. На практике их применяют для уничтожения микробов на объектах окружающей среды (серная, соляная, уксусная), создания определенной величины рН в питательных средах (соляная кислота); при изготовлении и консервировании пищевых продуктов (уксусная, лимонная), так как кислая реакция среды (кислотность) неблагоприятна для развития гнилостных микроорганизмов. Бактерицидность щелочей зависит от диссоциации и концентрации гидроксильных ОН-ионов. Наиболее часто в ветеринарной практике применяют NaOH (гидроксид натрия) и КОН (гидроксид калия), гашеную известь (гидроксид кальция), натрия карбонат (Na2C03), натрия гидрокарбонат (сода). Бактерицидное действие проявляется при сравнительно невысокой концентрации щелочей: гибель вегетативных форм микроорганизмов наступает под влиянием 2-3% -ного, спор бацилл 4-5% -ного растворов. Поверхностно-активные вещества. Катионные детергенты (церигель, дегмицид, этоний, декаметоксин и роккал) представляют собой соединения четвертичных аммонийных оснований, содержащих радикалы с длинной цепью углеродных атомов. Анионные детергенты нарушают проницаемость и осмотическое равновесие микробной клетки, что и приводит к ее гибели, к нимотносится зеленое мыло. Спирты. Практический интерес из этой группы соединений представляет спирт этиловый (С2Н50Н). Антимикробная активность его обусловлена способностью отнимать воду и свертывать белок. Бактерицидное действие оказывает уже 20%-ная концентрация спирта, но наиболее эффективен 70%-ный спирт. Более высокие концентрации спирта (80-90%) в белковой среде образуют плотные белковые сгустки, внутри которых могут сохраняться живые бактерии. Бактерицидность спиртов зависит от их молекулярной массы по мере ее возрастания: метиловый — этиловый — пропиловый — бутиловый -^ амиловый и т, д. Красители. Обладают свойствами подавлять рост бактерий. Они действуют медленно, но более избирательно. К ним относятся бриллиантовый зеленый, этакридина лактат, фла-вакридина гидрохлорид, метиленовый синий и др. Бриллиантовый зеленый; соединяясь с белком, липидами или муко полисахаридами бактериальной клетки, приводит к ее гибели* Акридин блокирует у бактерий жизненно необходимые для обмена анионные группы катионами акридина. Метиле-новый синий, выполняя роль акцептора и донора ионов водорода, изменяет течение окислительно-восстановительных реакций и нарушает жизнеспособность микробной клетки. Эти средства особенно эффективны при кокковых инфекциях. Фенол, крезол и их производные. Эффективность действия препаратов этой группы обусловлена их способностью легко проникать через фосфолипиды клеточных мембран, денатурировать белок цитоплазмы и подавлять функцию ко-фермента (дифосфопиридин нуклеотида), участвующего в дегидрировании глюкозы и молочной кислоты, что сопровождается глубокими нарушениями метаболизма и гибелью патогенных микробов. Белок не препятствует противомик-робной активности фенола, что дает ему преимущество перед другими дезинфектантами.- Формальдегид. Представляет собой бесцветный газ. В практике применяют 40% -ный водный раствор формальдегида (формалин). Растворенный в воде формальдегид губительно влияет на вегетативные и споровые формы бактерий; вызывает дегидратацию поверхностных слоев, легко проникает в бактериальную клетку, вступает в связь с аминогруппами белков, денатурирует их. Химические вещества (хлор и хлорсодержащие вещества, гидроксид натрия, фенолы, формальдегид) широко используют для дезинфекции и химической стерилизации. Дезинфекция — уничтожение только патогенных микроорганизмов в окружающей среде, а не всех микробов вообще, находящихся на объекте. Качество дезинфекции оценивают бактериологическим методом. В качестве тест-микробов используют кишечную палочку или золотистый стафилококк в зависимости от инфекции, при которой проводится дезинфекция. После дезинфекции берут с помощью ватно-марлевых тампонов пробы смывов с поверхностей разных обработанных объектов, помещают их в раствор нейтрализатора дезсредства, а затем засевают на питательные среды. Дезинфекцию считают удовлетворительной при отсутствии роста тест-микробов на питательных средах. |
