1 лаба гидро. Лабораторная работа 1 "Формы выражения результатов химического анализа пластовых вод нефтяных и газовых месторождений"
 Скачать 22.16 Kb. Скачать 22.16 Kb.
|
|
Лабораторная работа №1 "Формы выражения результатов химического анализа пластовых вод нефтяных и газовых месторождений" Задачи: 1) Рассчитать содержание ионов в весовой, эквивалентной и процент-эквивалентной формах, определить содержание шестого главного иона (Na+ + К+), , выразить химический состав воды с помощью формулы М. Г. Курлова. В таблице 5 приводятся варианты с данными для химического анализа пластовых вод (содержание пяти главных ионов представлено в г/100 г). 2) Рассчитать жесткость и минерализацию воды по пробам (табл.5). Дать характеристику вод по степени жесткости и минерализации используя классификации В. И. Вернадского, О.А. Алексина. Вариант 13.
Найдем эквивалент иона, который является частным от деления ионной массы на валентность иона.
rNa+ = (143,8+ 0,5 + 0) – (27,9 + 8,4) = 108 мг-экв Na+ = 108 * 23 = 2484 мг Процент - молярная (эквивалентная) форма. %-экв=(a/ Σra + Σrk)*100 %-экв %-экв (Cl– ) = (143,8/288,6)*100 = 49,8%-экв %-экв (SO42–) = (0/288,6)*100 = 0 %-экв %-экв (HCO3– )= (0,5/288,6)*100 = 0,2 %-экв %-экв (Ca2+) = (27,9/288,6)*100 =9,7%-экв %-экв (Mg2+) = (8,4/288,6)*100 = 2,9 %-экв %-экв (Na+) = (108/288,6)*100 = 37,4 %-экв Формула Курлова 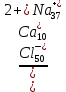 Вода хлоридная натрий-кальциевая. Жесткость воды определяется содержанием растворённых солей кальция и магния. Общая жесткость обусловлена суммарным содержанием ионов Са2+ и Mg2+ . Таблица 1.3 - Классификация О.А. Алексина по степени жесткости (1мг-экв/л равен 2,8о )
(Mg2+ + Са2+) =0,103 +0,558 = 0,661 мг-экв/л Немецкий градус жесткости 0,661 * 2,8 = 1,8508 о По этой классификации воды принадлежат к очень мягким. Согласно классификации В. И. Вернадского, О.А. Алексина по общей минерализации выделяют следующие воды. Пресные — с общей минерализацией до 1 г/л, Солоноватые — от 1 до 10 г/л, Соленые — от 10 до 50 г/л Рассолы — 50 до 400 и более г/л (слабые (50-100), крепкие (100-270), очень крепкие (270-350) и сверхкрепкие (> 350)). Минерализация воды определяется содержанием растворённых минеральных веществ и рассчитывается как арифметическая сумма весовых количеств всех ионов в 1л (дм3) воды 5,033 +0+0,032+0,103+0,558+2,484=8,21 Воды являются солоноватыми Вывод: вода данного состава по формуле Курлова является хлоридной натрий-кальциевой. По классификации О.А.Алексина воды принадлежат к очень мягким. По В.И.Вернадскому воды являются солоноватыми. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
