ЛР 15 электрохимический эквивалент меди. Лабораторная работа 15 Определение электрохимического эквивалента меди Цель работы определить электрохимический эквивалент меди
 Скачать 38.01 Kb. Скачать 38.01 Kb.
|
|
Лабораторная работа № 15 Определение электрохимического эквивалента меди Цель работы: определить электрохимический эквивалент меди. Оборудование: весы, амперметр, часы, аккумулятор, реостат, ключ, медные электроды, соединительные провода, электролитическая ванна с раствором медного купороса. Теория: Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах, с материалом электродов или растворителей. Примером может служить электролиз водного раствора сульфата меди CuSO4 (медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди. Диссоциация молекул сульфата меди происходит по схеме 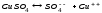 . Нейтральные атомы меди отлагаются в виде твердого осадка на катоде. Таким путем можно получить химически чистую медь. Ион . Нейтральные атомы меди отлагаются в виде твердого осадка на катоде. Таким путем можно получить химически чистую медь. Ион 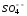 отдает аноду два электрона и превращается в нейтральный радикал, вступает во вторичную реакцию с медным анодом: SO4+Cu=CuSO4. Образовавшаяся молекула сульфата меди переходит в раствор. отдает аноду два электрона и превращается в нейтральный радикал, вступает во вторичную реакцию с медным анодом: SO4+Cu=CuSO4. Образовавшаяся молекула сульфата меди переходит в раствор.Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложение меди на катоде. Концентрация раствора сульфата меди при этом не изменяется. Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе: масса вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит: m=kQ=kIt. Величину называют k электрохимическим эквивалентом, для каждого вещества является величиной постоянной: 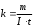 , [ , [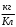 ] ]Для усвоения данной темы посмотреть видео по ссылкам: https://youtu.be/GG3kUOXL9kQ https://youtu.be/N3TMaC42vik Порядок выполнения работы. 1. Очистить наждачной бумагой катодную пластину, промыть и просушить её. Определить на весах массу пластинки с точностью до 0,01г (m1). Начальную массу пластинки m1 записать в таблицу. 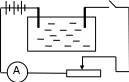 2. Составить электрическую цепь по схеме: 3. Замкнуть цепь и заметить время включения тока. 4. При помощи реостата в течение всей работы поддерживать постоянную величину тока. Значение силы тока I записать в таблицу 5. Остановить секундомер (значение времени t записать в таблицу) разомкнуть цепь, вынуть катодную пластину. 6. Определить взвешиванием массу m2 катодной пластинки (конечную массу пластинки m2 записать в таблицу). 7. Вычислить массу выделившейся меди по формуле m= m2- m1 8. Вычислить электрохимический эквивалент меди по формуле: 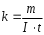 9. Вычислить погрешность измерения, занести данные в таблицу. kтабл. взять из сборника Гладковой стр 381 табл XVII Δk = | kтабл - kэксп | Ɛ k = 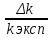 * 100% * 100%
Экспериментальные данные взяты из выполненной на очном занятии данной лабораторной работы. 10. Сделайте вывод. Контрольные вопросы. Ответьте на вопросы теста: 1. Анод – это: а) положительный электрод б) отрицательный электрод в) нейтральный электрод 2. Катод – это: а) положительный электрод б) нейтральный электрод в) отрицательный электрод 3. Движение ионов под действием электрического тока становится: а) упорядоченным б) прекращается вообще в) хаотичным Ответьте на вопросы: 4. Будет ли выделяться вещество на электродах в электролитической ванне, если их включить в городскую сеть? 5. Приведите примеры применения электролиза. |
