Название опыта
|
Проведение опыта
|
Уравнение реакции
|
Наблюдение
|
Особенности проведения опыта. Открываемый минимум.
|
Частные реакции катиона Ag+.
|
1.Реакция с хлоридами.
|
К 4 каплям раствора нитрата серебра добавили столько же капель 2 н. HCl, разделили содержимое микропробирки на 4 части и определили растворимость полученного осадка в растворах HCl, HNO3 и конц. растворе NH3. Одну пробирку с осадком оставили и наблюдали за происходящими с ним изменениями на свету.
Раствор, полученный при растворении AgCl в конц. растворе NH3, разделили на две пробирки. В одну из них прибавили несколько капель раствора HNO3, в другую – несколько капель раствора KI.
|
[Ag(NH3)2]Cl + 2HNO3 =
= AgCl↓ + 2NH4NO3
[Ag(NH3)2]Cl + KI = AgI↓ + + KCl + 2NH3↑
|
При взаимодействии нитрата серебра с соляной кислотой выделился белый творожистый осадок.
При добавлении кислот с осадком ничего не произошло.
В концентрированном растворе NH3 осадок растворился.
|
Открытию катионов Ag+ реакцией с хлорид-ионами мешают катионы Cu2+, [Hg2]2+, Pb2+, Au+, Tl+.
Открываемый минимум –
10 мкг.
|
2.Реакция с иодидами.
|
К 4 каплям раствора нитрата серебра добавили столько же капель раствора KI, разделили содержимое микропробирки на 4 части и определили растворимость полученного жёлтого осадка в растворах H2SO4, CH3COOH, NH3.
|
AgNO3+KI =AgI↓+KNO3
AgI↓ + 2Na2S2O3 =
= Na3[Ag(S2O3)2] + NaI
|
При взаимодействии AgNO3 и раствора KI выпал желтый осадок.
Осадок не растворился в серной и уксусной кислотах.
Йодид серебра, в отличие от бромида и хлорида, нерастворим в аммиаке - слишком низкое ПР.
Осадок растворился в тиосульфате натрия с образованием комплексного соединения.
|
|
3. Реакция с гидроксидами натрия или калия.
|
К 3 каплям раствора нитрата серебра добавили столько же капель раствора NaOH. К выпавшему бурому осадку добавили избыток раствора аммиака.
|
2Ag+ + 2OH- = Ag2O↓ + +H2O
Ag2O↓ + 4NH3·H2O =
= 2[Ag(NH3)2]OH + 3H2O
|
При взаимодействии AgNO3 и раствора KOH образуется бурый осадок.
В избытке аммиака осадок растворяется.
|
Растворение Ag2O в NH3·H2O необходимо вести в присутствии соли аммония, так как иначе возможно образование азида серебра Ag3N, взрывающегося от малейшего сотрясения.
|
4. Реакция восстановления.
|
К 4 каплям раствора нитрата серебра добавили раствор аммиака до растворения первоначально образовавшегося осадка.
К полученному раствору добавили 2 капли раствора формальдегида и содержимое пробирке нагрели.
|
AgNO3 + 3NH3·H2O(изб.) = = [Ag(NH3)2]OH + NH4NO3 + + 2H2O
HCOH + 4[Ag(NH3)2]OH =
= 4Ag↓ + (NH4)2CO3 +
+ 6NH3↑+ 2H2O.
|
На стенках пробирке образуется «серебрянное зеркало».
|
Реакции мешают ионы ртути и сильные окислители.
|
5. Реакция с хроматами
|
К 4 каплям раствора нитрата серебра добавили 2 капли раствора хромата калия до появления кирпично-красного осадка. разделили содержимое микропробирки на 3 части и подействовали на него растворами H2SO4, HCl, NH3(конц.).
|
2Ag+ + CrO42- = =Ag2CrO4↓
Ag2CrO4↓+4NH3·H2O(конц.) → [Ag(NH3)2]2CrO4 + +4H2↑
|
При взаимодействии нитрата серебра и хромата калия образуется кирпично-красный осадок. Хромат серебра растворим в избытке аммиака. С кислотами раствор окрашивается в желтый цвет.
|
Реакцию следует проводить в нейтральной среде, так как в щелочной среде образуется оксид, а в кислой происходит растворение осадка.
Открытию катионов Ag+ реакцией с хромат-ионами мешают катионы Sr2+, [Hg2]2+, Pb2+, Ba2+, Hg2+, Bi3+ и др.
|
Частные реакции катиона Pb2+.
|
1.Реакция с хлоридами.
|
К 4 каплям раствора нитрата свинца (II) добавили 4 капли этилового спирта и столько же
капель 2 н. HCl.
К выпавшему осадку прилили 6 капель дистиллированной воды и перемешали содержимое пробирки. Нагрели содержимое пробирки. Охладили раствор до комнатной температуры. Добавили несколько капель этилового спирта.
|
Pb(NO3)2 + 2HCl = PbCl2↓+ +2HNO3
|
При взаимодействии нитрата свинца с соляной кислотой образуется белый осадок, после нагревания осадок растворился, при охлаждении до комнатной температуры снова появился осадок.
|
Реакцию следует проводить в нейтральной среде, так как в щелочной среде образуется гидроксид свинца (II).
Открытию катионов Pb2+ реакцией с хлорид-ионами мешают катионы Cu2+, [Hg2]2+, Ag+, Au+, Tl+.
Открываемый минимум – 0,04 мкг.
|
2.Реакция с иодидами.
|
К 3 каплям раствора нитрата свинца (II) добавили столько же капель раствора KI.
К полученному осадку добавили несколько капель дистиллированной воды и 3 капли 2 н. раствора уксусной кислоты и нагрели.
|
Pb2+ + 2I¯= PbI2↓
|
Образуется желтый осадок. После добавления дистиллированной воды и раствора уксусной кислоты.
Осадок растворяется, но при медленном охлаждении вновь образуется в виде блестящих золотистых кристалликов.
|
Реакцию следует проводить при рН=3-5. Следует избегать избытка KI, так как
иодид свинца (II) растворяется в избытке иодида калия с образованием комплексного соединения K2[PbI4].
Открытию катионов Pb2+ реакцией с иодид-ионами мешают катионы Cu2+, [Hg2]2+, Hg2+, Ag+, Fe3+, Bi3+.
Открываемый минимум – 100 мкг.
|
3. Реакция с гидроксидами натрия или калия
|
К 4 каплям раствора нитрата свинца (II) добавили столько же капель раствора KOH.
К выпавшему белому осадку добавили избыток раствора аммиака.
|
Pb2+ + 2OH¯= Pb(OH)2↓
|
При взаимодействии нитрата свинца с гидроксидом натрия выпал белый осадок. При добавлении аммиака осадок не растворился.
|
|
4. Реакция с сульфатами
|
К 3 каплям раствора нитрата свинца (II) добавили столько же капель раствора, содержащего сульфат-ионы.
Раздели осадок на три части и подействовали на него при нагревании щёлочью, концентрированной серной кислотой и 30%-ным раствором ацетата аммония или натрия
|
PbSO4 + 4NaOH =
= Na2[Pb(OH)4] + Na2SO4
PbSO4 + H2SO4= Pb(HSO4)2
2PbSO4 + 2CH3COONH4= =[Pb(CH3COO)]2SO4 + (NH4)2SO4.
|
Выпадает белый осадок PbSO4.
Осадок растворим при нагревании в растворах щелочей. Также растворяется при нагревании с концентрированным раствором СН3СООNН4.
|
Открытию катионов Pb2+ реакцией с сульфат-ионами мешают катионы, образующие малорастворимые сульфаты (Cа2+, Sr2+, Ba2+, [Hg2]2+ и др).
|
5. Реакция с хроматами.
|
К 4 каплям раствора нитрата свинца добавили 2 капли раствора хромата калия.
Разделили содержимое микропробирки на
3 части и подействовали на него растворами H2SO4, HCl, NH3(конц.)
|
Pb(NO3)2+K2CrO4=PbCrO4↓++2KNO3
PbCrO4 + H2SO4 = PbSO4 +
+H2CrO4
2PbCrO4 + 16HCl = 2PbCl2 + + 2CrCl3 + 3Cl2 + 8H2O
|
При взаимодействии нитрата свинца с хроматом калия образуется кирпично-красный осадок. В аммиаке осадок практически не растворим. В кислотах осадок растворяется.
|
Реакцию следует проводить в нейтральной среде, так как в щелочной среде образуется оксид, а в кислой происходит растворение осадка.
Открытию катионов Ag+ реакцией с хромат-ионами мешают катионы Sr2+, [Hg2]2+, Pb2+, Ba2+, Hg2+, Bi3+ и др.
|
6. Реакция с дитизоном (дифенилтиокарбазоном).
|
К 4 каплям раствора нитрата свинца (II) добавили 3 капли раствора дитизона в хлороформе.
|
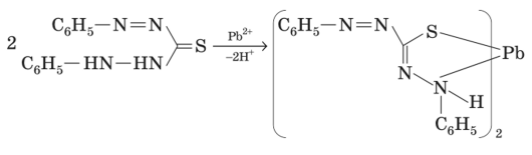
|
В результате экстрагирования хлороформный слой окрашивается в красный цвет (образуется внутрикомплексное соединение).
|
Открытию катионов Pb2+ реакцией с дитизоном мешают катионы Cu2+, Zn2+, Ag+ и др.
Эта реакция является специфической для обнаружения [Hg2]2+ в растворе.
Открываемый минимум – 0,80 мкг.
|
 Скачать 74.87 Kb.
Скачать 74.87 Kb.
