лабораторная работа 6.3 сибгути. Лаба 6.3. Лабораторная работа 3 определение потенциала ионизации аргона выполнил студент группы ап103 Гальцев Е. А. Проверил преподаватель
 Скачать 278.39 Kb. Скачать 278.39 Kb.
|
|
Федеральное агентство связи ФГБОУ ВО «СибГУТИ» Кафедра физики Лабораторная работа 6.3 ОПРЕДЕЛЕНИЕ ПОТЕНЦИАЛА ИОНИЗАЦИИ АРГОНА Выполнил студент группы АП-103: Гальцев Е.А. Проверил преподаватель: Сундукова М.С. Измерения сняты __________________________ Дата, подпись преподавателя Отчет принят ______________________________ Дата, подпись преподавателя Работа зачтена_____________________________ Оценка, дата, подпись преподавателя НОВОСИБИРСК 2022 ЦЕЛЬ РАБОТЫ Определить потенциал ионизации атомов аргона. ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ СВЕДЕНИЯ Согласно современным теоретическим представлениям атомные системы могут находиться только в некоторых определенных состояниях, называемых стационарными. Каждому стационарному состоянию соответствует свое фиксированное значение энергии. Спектр допустимых значений энергий атомов является дискретным. Состояние с наименьшим допустимым значением энергии атома называется основным состоянием. Часто при взаимодействиях атома с внешними системами изменяется состояние только валентного (внешнего) электрона. Поэтому в данной работе мы будем считать, что энергия атома эквивалентна энергии валентного электрона, а состояние атома и состояние валентного электрона будем считать синонимами. Значения энергии разрешенного состояния называют энергетическими уровнями. На энергетических диаграммах энергетические уровни обозначают черточками. Если атом находится в основном состоянии, то все энергетические уровни, расположенные ниже энергетического уровня валентного электрона, заняты электронами, а все вышележащие уровни – свободны, смотри рисунок 3.1(а). 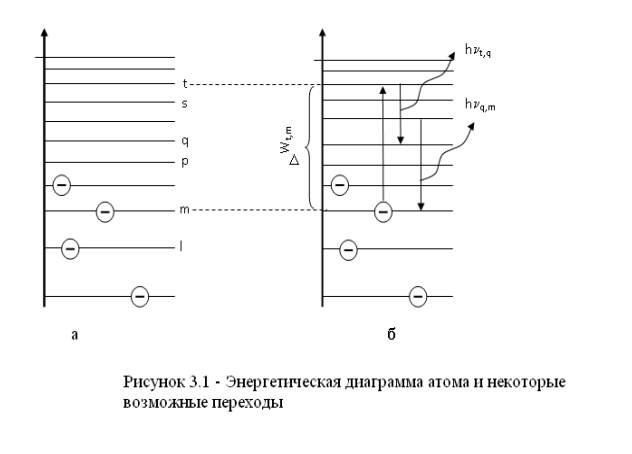 В случае внешних воздействий атом, т.е., как правило, один из его валентных электронов может получить дополнительную энергию W и перейти в какоелибо из разрешенных состояний с большей энергией, рис. 3.1(б). Такое состояние атома называется возбужденным. В возбужденном состоянии атом долго находиться не может. Очень быстро он спонтанно (самопроизвольно) возвращается непосредственно в основное состояние или переходит в одно из возбужденных состояний с меньшей энергией, например с уровня t на уровень m на рисунке 3.1(б). Переход атомной системы из состояния с большей энергией Wk в состояние с меньшей энергией Wn сопровождается выделением энергии W Wk Wn (1) которая излучается в виде кванта электромагнитного излучения h , так что: h Wk Wn (2) Соотношение (2) называется правилом частот. Энергию возбуждения часто характеризуют потенциалом возбуждения. При этом под потенциалом возбуждения понимают ту разность потенциалов, которую должен пройти электрон, чтобы приобрести энергию, равную данной энергии возбуждения. Если подведенная извне энергия превысит модуль энергии основного состояния валентного электрона, то валентный электрон, получив эту энергию, выйдет за пределы атома и станет свободным. Такой процесс называется ионизацией атома. В результате ионизации, нейтральный атом превращается в положительно заряженный ион и, кроме того, появляется свободный электрон. Минимальная энергия, при которой возникает ионизация атомов, называется энергией ионизации Wi . Энергия ионизации атомов зависит от структуры атомов и характеризуется потенциалом ионизации. Потенциал ионизации равен той разности потенциалов, которую должен пройти электрон, чтобы приобрести энергию, равную энергии ионизации атома. ОПИСАНИЕ УСТАНОВКИ 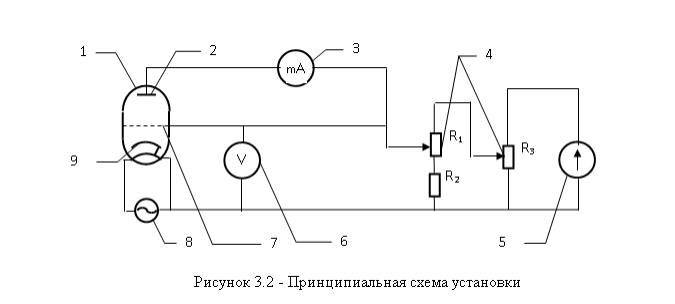 Установка, рис. 3.2, состоит из тиратрона (1), гальванометра (3), включенного в анодную цепь тиратрона, источника напряжения анодной цепи (5), вольтметра (6), измеряющего ускоряющее напряжение, источника питания (8) накала катода тиратрона. Потенциометры (4) служат для регулировки ускоряющего напряжения анодной цепи тиратрона. Тиратрон представляет собой стеклянный баллон (1), заполненный аргоном с малым давлением. В баллон помещены три электрода: катод (9) подогревного типа, сетка (7) и анод (2). Под действием напряжения накала нить накала и катод разогреваются. Возникает явление термоэлектронной эмиссии. Вследствие термоэлектронной эмиссии, вокруг разогретого катода образуется электронное облако. К катоду и сетке подведено ускоряющее напряжение. Под действием ускоряющего поля электроны, эмитируемые катодом, ускоряются, проходят сквозь ячейки сетки, далее попадают на анод (2) и регистрируются гальванометром (3) в виде анодного тока, рис.3.3. 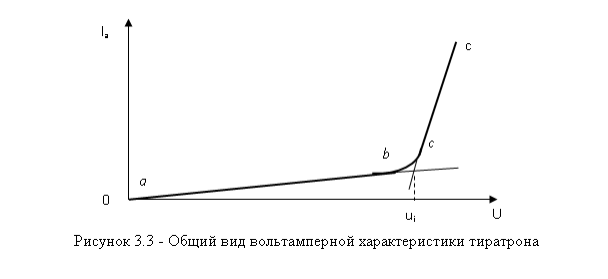 Увеличение ускоряющего напряжения сопровождается возрастанием анодного тока, участок a b на рис.3.3. На участке a b явления ионизации не происходит, поэтому рост силы тока достаточно слаб. При прохождении участка катод-сетка, электроны приобретают: W eU (3) Если окажется, что энергия электронов больше, чем энергия ионизации: W Wi (4) то катодные электроны, сталкиваясь с атомами аргона в области за сеткой, ионизируют атомы аргона. Ионизация атомов аргона сопровождается увеличением концентрации свободных электронов, создающих анодный ток, и, кроме того, образующиеся из атомов аргона положительные ионы, двигаясь к катоду, вносят дополнительный вклад в рост силы анодного тока. Вследствие этого, крутизна возрастания анодного тока резко увеличивается, участок b c на рис. 3.3. Напряжение излома вольтамперной характеристики тиратрона, рис. 3.3, позволяет нам определить потенциал ионизации атомов аргона. ВЫПОЛНЕНИЕ РАБОТЫ
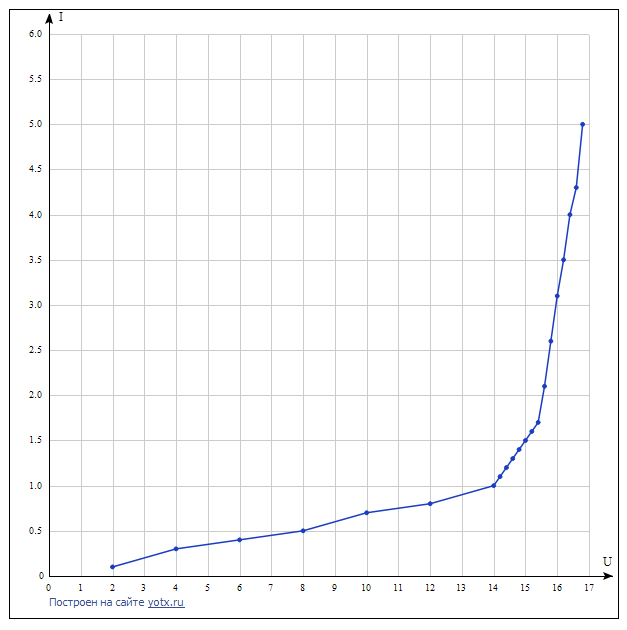 график зависимости I(U). 𝑈𝑖 = В КОНТРОЛЬНЫЕ ВОПРОСЫ Объясните в общих чертах строение атомов. Строение атома можно описать несколькими тезисами: a) Сам атом является электронейтральной частицей, состоит из ядра и электронного облака. b) Ядро атома состоит из нескольких протонов и нейтронов. Они удерживаются в ядре за счет сильного взаимодействия. c) Вокруг ядра атома, по орбитам вращаются электроны. При химических реакциях меняется лишь строение электронных оболочек между атомами, при этом ядра атомов остаются без изменений. d) Ядро занимает ничтожную часть объёма атома, при этом в ядре сосредоточена почти вся масса атома. Например, атом аргона состоит из ядра, состоящего из 18 протонов и 22 нейтронов, вокруг которого по 3-м орбитам движутся 18 электронов. 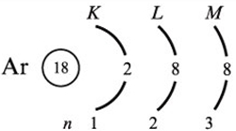 схематическое строение атома аргона. Какие состояния называются стационарными? Стационарное состояние – состояние атома, при котором количество внутренней энергии не изменяется с течением времени. Каждый атом имеет определённый набор энергий, характеризующих его состояние. Первое стационарное состояние атома является наиболее устойчивым и его ещё называют основным стационарным состоянием. В этом состоянии у атома наименьшее допустимое значение энергии.  Что называют возбуждением атомов и ионизацией атомов? Возбуждённое состояние атома – состояние, в котором атом находится довольно короткий срок времени, и после атом либо возвращается в стационарное состояние, либо переходит в одно из возбуждённых состояний с меньшей энергией. Ионизация атома – процесс, при котором валентный электрон проходит разность потенциалов, которая превышает модуль энергии валентного электрона. Получив эту энергию, электрон становится свободным. В итоге, нейтральный атом превращается в положительно заряженный электрон, а также появляется свободный электрон. Минимальная энергия, при которой возникает ионизация атомов, называется энергией ионизации Wi. Энергия ионизации атомов зависит от структуры атомов и характеризуется потенциалом ионизации. Что называют потенциалом ионизации атомов? Потенциал ионизации атомов – минимальная разность потенциалов U, которую должен пройти электрон в ускоряющем электрическом поле, чтобы приобрести кинетическую энергию, достаточную для ионизации атома. Что понимают под энергетическими уровнями атомов. 31 Энергетические уровни - это те значения энергии, которые может принимать электрон в атоме. Если атому водорода сообщить энергию, то его электрон примет значение энергии отличное от значения энергии первого уровня, условно выражаясь, в этом случае электрон первого энергетического уровня атома водорода "перескочит" на второй уровень и т.д., пока от атома не "оторвется" и атом не превратится в ион. Поясните схему и принцип действия лабораторной установки. Установка состоит из тиратрона, гальванометра, включенного в анодную цепь тиратрона, источника ускоряющего поля, вольтметра, измеряющего ускоряющее напряжение, и источника накала катода тиратрона. Тиратрон представляет собой стеклянный баллон, заполненный аргоном с малым давлением. В баллон помещены три электрода: катод подогревного типа, сетка и анод. Под действием напряжения накала нить накала и катод разогреваются. Возникает явление термоэлектронной эмиссии. Вследствие термоэлектронной эмиссии, вокруг разогретого катода образуется электронное облако. К катоду и сетке подведено ускоряющее напряжение. Под действием ускоряющего поля электроны, эмитируемые катодом, ускоряются, проходят сквозь ячейки сетки, далее попадают на анод и регистрируются гальванометром в виде анодного тока. 7. Почему крутизна вольтамперной характеристики резко увеличивается, когда ускоряющее напряжение превышает потенциал ионизации атомов? Катод, сетка и анод расположены в тиратроне таким образом, что практически все электроны, в том числе испытавшие упругие и неупругие столкновения с атомами аргона, попадают на сетку. На анод летит совсем немного электронов, вследствие чего ток в анодной цепи очень мал. Такая ситуация будет сохраняться до тех пор, пока ускоряющее напряжение меньше потенциала ионизации атома аргона. Но как только превысит потенциал ионизации, в пространстве между катодом и сеткой появятся положительные ионы, которые частично скомпенсируют объёмный отрицательный заряд электронного облака. Вследствие этого электронный ток на сетку резко возрастет, увеличится также и доля тока, поступающего на анод. |
