лаба 4. Лабораторная работа 4 Роль комплексообразования в процессах катодного восстановления и анодного растворения меди
 Скачать 7.69 Mb. Скачать 7.69 Mb.
|
|
Министерство науки и высшего образования РФ Федеральное государственное бюджетное образовательное учреждение высшего образования Казанский национальный исследовательский технологический университет (ФГБОУ ВО «КНИТУ») Кафедра технологии электрохимических производств Лабораторная работа № 4 «Роль комплексообразования в процессах катодного восстановления и анодного растворения меди» Выполнили студенты группы 4201-32 Протасова Арина Королева Виктория Баранов Иван Баранов Павел Казань-2023 Теоретическая часть Изучение кинетических закономерностей растворения металлов при анодной и катодной поляризации является необходимым условием развития теоретической электрохимии, а также совершенствования таких практически важных разделов электрохимии, как гальванотехника, химические источники тока, рафинирование металлов, электрохимическая обработка металлов и для более полного понимания процессов, происходящих при коррозии и катодной защите металлов. Если анодное растворение меди изучено достаточно широко, то растворению меди при катодной поляризации посвящено весьма ограниченное количество работ. При этом скорость растворения в последнем случае определялась как средняя за длительный промежуток времени, и полученные данные недостаточны и не систематичны, чтобы судить о механизме этого процесса и о составляющих его парциальных реакциях. В то же время было ясно, что растворение меди при катодной поляризации протекает в присутствии растворенного молекулярного кислорода и продуктов окисления меди. Поэтому возникает необходимость исследования кинетики анодного растворения меди в их присутствии, чтобы правильно получить (экстраполяцией) значения скоростей анодного растворения меди при заданных потенциалах. Так как скорость растворения меди при катодной поляризации оказывается намного выше скорости, полученной экстраполяцией анодной кривой, то такое растворение называют аномальным. Исследование аномального растворения меди, в отличие от широко изученного аномального растворения железа, хрома, никеля и др., представляет особый интерес, т.к. катодная поляризация меди позволяет в большей степени сместить электродный потенциал в отрицательную сторону по сравнению с равновесным значением. Получены новые доказательства того, что кинетика анодного растворения меди в активной области в сульфатных и хлоридных средах остается неизменной при введении окислителя (кислорода) или одноименных ионов (одно- или двухзарядных), а искажается лишь форма потенциометрической поляризационной кривой. Также показано, что в хлоридных средах химической реакции диспропорционирования не наблюдается из-за образования устойчивых комплексов с анионами раствора. Установлено, что медь в активном состоянии в гидрокарбонатных средах растворяется двухстадийно с диффузионной лимитирующей стадией, а потенциалопределяющей реакцией является равновесие между медью и ионами Си2+. Впервые систематически исследовано растворение меди при катодной поляризации. Установлено, что анионный состав не оказывает влияния на растворение меди, а повышение кислотности электролита увеличивает скорость растворения. Выявлено, что скорость аномального растворения прямо пропорциональна скорости подвода кислорода к электроду. Реакция выделения водорода на медном электроде приводит к перемешиванию приэлектродного слоя и, как следствие, к ускорению доставки кислорода к поверхности электрода. Доказано, что растворение меди при катодной поляризации представляет собой результат двух противоположно направленных процессов: растворения меди и катодного восстановления продуктов её окисления. В связи с этим определение скорости аномального растворения меди по начальному участку временных зависимостей накопления меди в растворе дает величины минимально искаженные обратным осаждением продуктов окисления меди. Определение скорости за более длительные промежутки времени (больше 2 ч) приводит к искаженным результатам. Впервые показано, что растворение меди из сплавов меди с алюминием и цинком при катодной поляризации происходит с повышенной скоростью из-за высокой термодинамической активности меди на поверхности растворяющегося сплава. Исследована кинетика растворения меди в хлоридных, сульфатных и гидрокарбонатных средах при анодной и катодной поляризации. В последнем случае скорость растворения намного больше скорости растворения, полученной экстраполяцией анодных кривых к значениям соответствующих катодных потенциалов. Растворение меди при катодной поляризации именуется аномальным. Его величина зависит от концентрации растворенного молекулярного кислорода, кислотности, температуры и размешивания рабочего раствора, но не зависит от значений электродного потенциала и природы кислоты. Механизм анодного растворения меди в хлоридных и сульфатных растворах, содержащих кислород и продукты анодного окисления меди, не изменяется, но стационарные потенциалы и форма начального участка поляризационной кривой искажается. Смещение стационарного потенциала происходит из-за протекания процесса саморастворения меди с кислородной деполяризацией, но при сдвиге потенциала в анодную область потенциометрические поляризационные кривые в хлоридных и сульфатных растворах с окислителем совпадают с кривой, полученной в деаэрированной среде, и кривой, построенной по прямым аналитическим определениям меди в рабочем растворе. В присутствии одно- и двухвалентной меди экспериментальные анодные поляризационные кривые полностью совпадают с теоретическими зависимостями для ионизации металлов с диффузионной контролирующей стадией. С увеличением концентрации ионов меди начальные участки поляризационных кривых несколько смещаются в область положительных потенциалов, т.к. ионы меди выступают в качестве деполяризатора. В растворах сульфатов качественно наблюдается аналогичная картина. Однако, при увеличении концентрации Си2+ становится возможным процесс репропорционирования, что подтверждено методом ВДЭсК. Скорость аномального растворения меди, определенная по анализу рабочего раствора на окисленную медь через определенное время экспозиции, представляет собой в общем случае разность скоростей «истинного» аномального растворения меди и катодного восстановления продуктов окисления меди. Поэтому известные значения скоростей аномального растворения меди представляют собой разность скоростей этих процессов. Скорость аномального растворения изменяется во времени от положительных до отрицательных значений в зависимости от условий отвода и подвода продуктов окисления меди и степени насыщенности ими рабочего раствора. В случае стационарного электрода концентрация ионов меди в растворе монотонно увеличивается во времени и практически достигает постоянного значения по истечении 30 мин, а для вращающегося электрода концентрация меди в растворе нарастает со значительно большей скоростью, проходит через ярко выраженный максимум, а по истечении двух часов после начала эксперимента практически не меняется. Развиты представления о механизме аномального растворения меди. Необходимыми условиями такого растворения является восстановление растворенного кислорода и достаточно кислая среда. При катодной поляризации вследствие восстановления кислорода на поверхности электрода создается повышенная концентрация промежуточных продуктов восстановления молекулярного кислорода, которые, взаимодействуя с металлической медью, образуют оксиды, скорее всего, переменного состава СихОх/2. Последние в кислых средах растворяются с образованием двухвалентных ионов меди в сульфатных средах, в хлоридных - комплексов одновалентной меди типа СиС12", которые далее окисляются кислородом. Продукты окисления меди в случае их не удаления из раствора, по достижении определенной плотности центров кристаллизации на поверхности меди, могут восстанавливаться и маскировать «истинное» аномальное растворение меди. В нейтральных и щелочных средах кислородсодержащие поверхностные соединения менее растворимы, они трансформируются в фазовый оксид Си20. В результате, окисление меди резко тормозится во времени и скорость аномального растворения уменьшается. Следовательно, аномальное растворение является результатом химического сопряжения реакции катодного восстановления молекулярного кислорода и реакции окисления меди частицами О2" или другими частицами. Последняя реакция реализуется за счет частичного переноса энергии от катодного восстановления кислорода (за счет увеличения концентрации промежуточных частиц восстановления кислорода). Применение приложений теории графов к кинетике сложных гетерогенных процессов позволило получить кинетическую схему процесса и уравнение для скорости растворения, связывающее скорость окисления меди при катодной поляризации с потоком кислорода к электроду, рН среды и активностью меди на поверхности. Практическая часть Цель работы: исследовать кинетику и механизм электродных процессов в кислом и этилендиаминовом электролитах меднения. Методика эксперимента: снять катодные и анодные потенциостатические кривые и потенциадинамические поляризационные кривые со скорость развертки потенциала 2 и 10мВ/с в растворах следующего состава(моль/л): 1) 1.0 CuSO4+ 0.5H2SO4; 2) 0.4 CuSO4+0.8 NH2-CH2-CH2-NH2+0.4 (NH4)2SO4+0.2 Na2SO4+0.2NH2-CH2-COOH, pH =7.5-9.0. В качестве рабочего электрода использовали медный электрод площадью 4.2см2, запрессованный во фторопластовую обойму. Вспомогательным электродом служит платиновая пластина. Расчетная часть 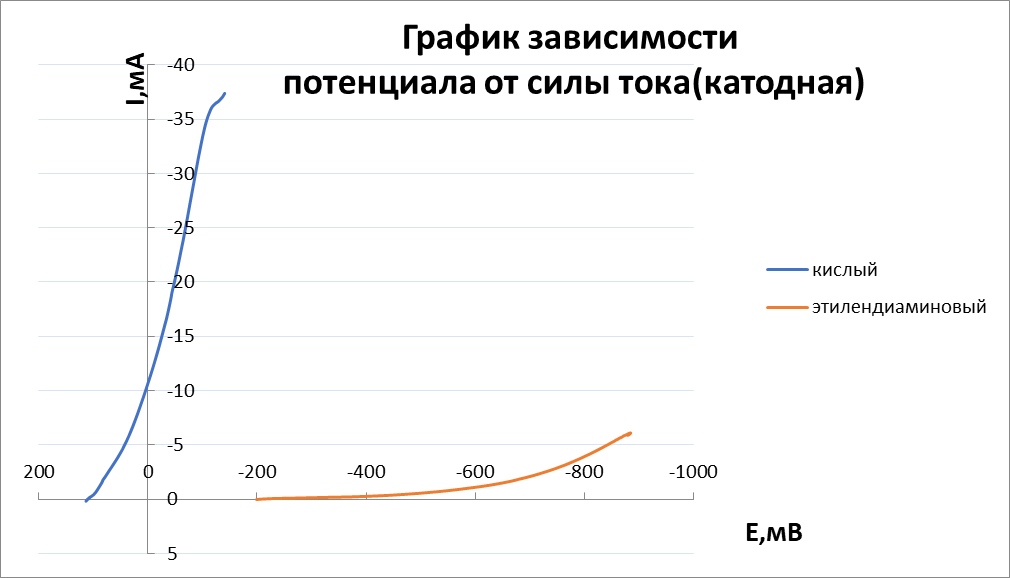 График 1  График 2  График 3 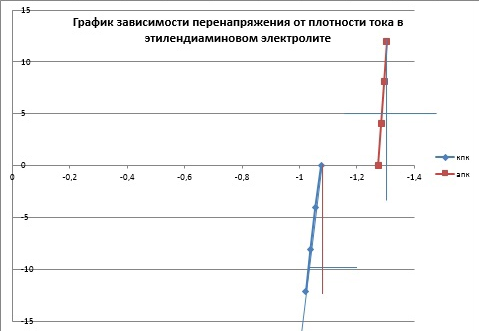 График 4 Таблица 1 Кинетические параметры электрохимической реакции
| |||||||||||||||||||||||||||||||||||||||||||||
