Лабораторная работа 5 Определение константы равновесия гомогенной химической реакции Суханова И. В
 Скачать 166.99 Kb. Скачать 166.99 Kb.
|
|
Министерство науки и высшего образования Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего образования ИРКУТСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ Институт высоких технологий Кафедра химической технологии им. Н.И. Ярополова Лабораторная работа 5 Определение константы равновесия гомогенной химической реакции Выполнил: Суханова И.В. _____________ Принял: Филатова Е.Г. _____________ Иркутск 2021 Цель работы: ознакомление с фотоколориметрическим методом, изучение равновесия гомогенной реакции. Задание: рассчитать константу равновесия гомогенной реакции и величину свободной энергии Гиббса. Приборы и материалы: фотометр КФК – 3; мерные колбы на 100 см3 – 8 шт.; бюретки на 25 см3 – 3 шт.; химический стакан на 100 см3 – 1 шт. Реактивы: FeCl3 – 0,1 Mэ; NH4CNS – 0,1 М; HCl – 50%; дистиллированная вода. Теоретическое введение Теоретические основы работы Химические реакции идут в сторону установления динамического равновесия, при котором в системе присутствуют и исходные вещества и продукты реакции, но отсутствует тенденция к изменению достигнутого состояния. В некоторых случаях концентрации продуктов в равновесной смеси настолько превышают концентрации непрореагировавших веществ, что с практической точки зрения реакция «завершается». Однако во многих важных случаях равновесия смесь содержит сопоставимые количества и реагентов, и продуктов реакции: ΔGp,T = 0 Уравнение для свободной энергии Гиббса справедливо, когда реакция не идет самопроизвольно ни в каком направлении, т.е. находится в равновесии (рис.1). Отсюда следует, что можно найти состав реакционной смеси и определить равновесные количества веществ, участвующих в химической реакции. Закон действия масс для реакции, протекающей обратимо в газовой фазе, имеет вид: Кр = (рCc*pDd) / (pAa*pBb) где Кр – константа равновесия; рC , pD , pA и pB – равновесные парциальные давления участников реакции. 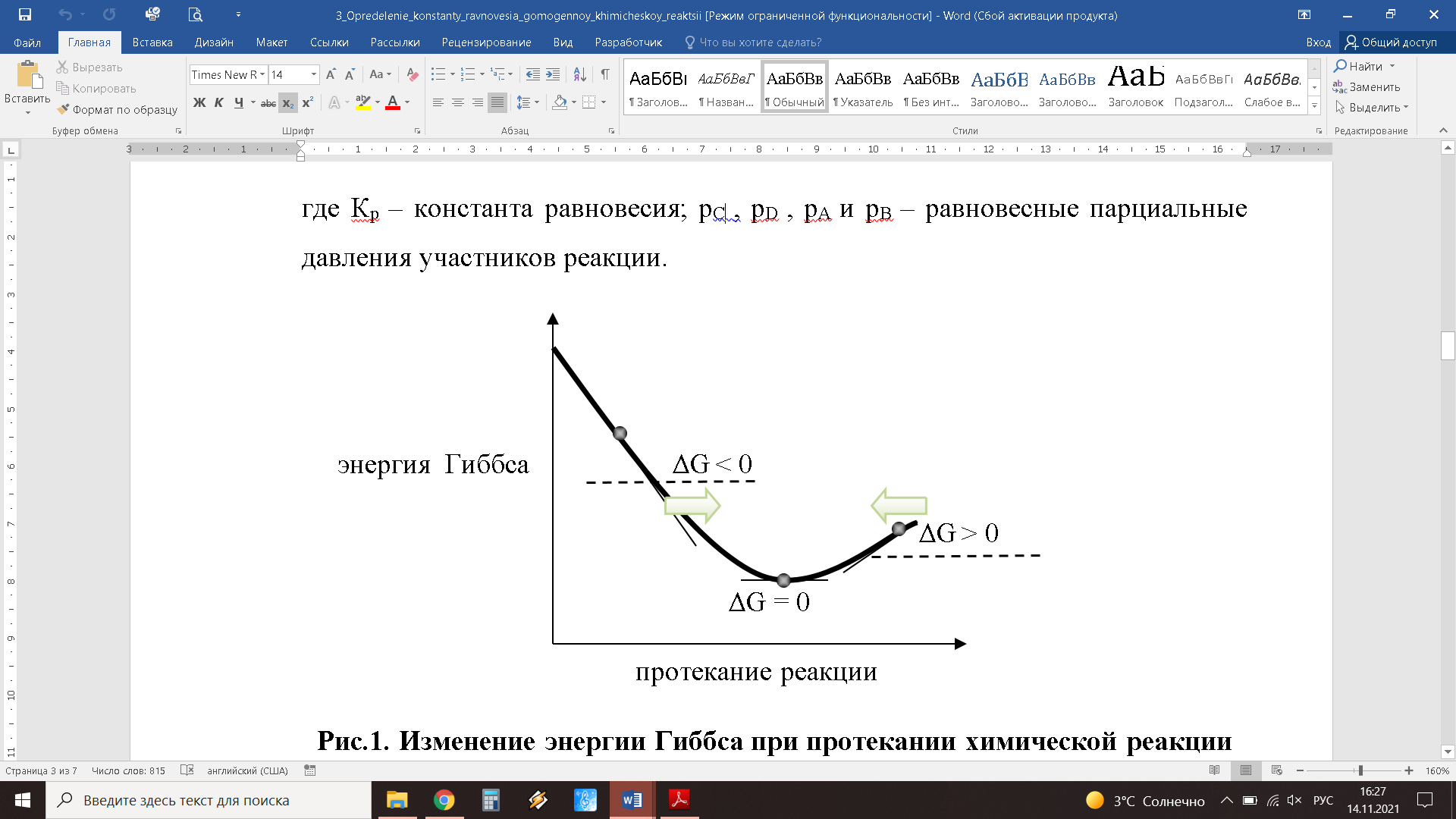 Рис.1. Изменение энергии Гиббса при протекании химической реакции Если реакция протекает в растворе (газовом, водном), то используется форма записи для константы равновесия через соответствующие равновесные концентрации в виде Кс = (рCc*pDd) / (pAa*pBb) (когда растворы имеют небольшую концентрацию). Существуют формы представления концентраций через другие характеристики раствора, причем одной и той же реакции все константы равновесия связаны известными соотношениями. Энергия Гиббса реакции и константа равновесия связаны одним из важнейших уравнений химической термодинамики, которое иногда называют уравнением химического сродства: ΔG0 = - RTlnKp В уравнении в записи константы равновесия подразумевается использование активностей, но при небольших концентрациях для газовых реакций можно использовать парциальные давления, для водных растворов - равновесные концентрации. Данное уравнение является строгим равенством, так как при его выводе не используется никаких допущений, с его помощью можно связать табулированные термодинамические данные и важную для практической химии константу равновесия. Можно рассчитать константы равновесий любых реакций, пользуясь таблицами термодинамических величин и таким образом оценивать равновесный состав реакционной смеси. Константа равновесия химической реакции зависит от условий протекания реакции - рН среды, давления и температуры и подчиняется принципу Ле-Шателье: если на систему, находящуюся в состоянии равновесия, оказать некоторое воздействие извне, то в системе произойдет смещение равновесия, которое ослабит эффект внешнего воздействия. Экспериментальное изучение зависимости константы равновесия от условий протекания реакций позволяет получать некоторые термодинамические характеристики (например, энтальпию) некалориметрическим методом. Например, одна из форм уравнения для описания влияния температуры на константу химического равновесия имеет вид: ln Kp = - ΔН/R * 1/T + B где В – постоянная интегрирования. Если Kp,Т1 – константа равновесия при температуре Т1, то Kp,Т2 – константа равновесия при температуре Т2, то ln ((Kp,Т2)/( Kp,Т1)) = = - ΔН/R * ( 1/Т2 – 1/Т1). Таким образом, зная константы равновесия при двух температурах, можно рассчитать изобарный тепловой эффект этой реакции ΔН. Экспериментальные результаты: Опыт 1. Построение градуировочной кривой
С(Fе(CNS)3) = 0,1*1/100*1/3 = 0,0003М С(Fе(CNS)3) = 0,1*2/100*1/3 = 0,0006М С(Fе(CNS)3) = 0,1*3/100*1/3 = 0,001М С(Fе(CNS)3) = 0,1*3,5/100*1/3 = 0,0012М 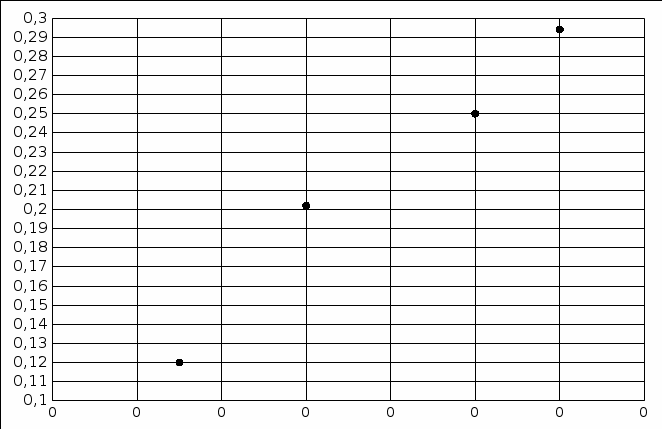 Опыт 2. Определение константы равновесия и расчет энергии Гиббса исследуемой реакции
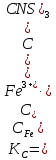 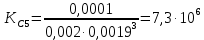 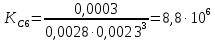 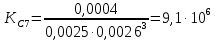 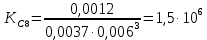 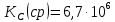 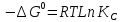 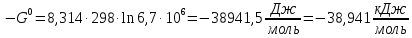 Вывод: В данной лабораторной работе ознакомилась с фотоколориметрическим методом изучения равновесия гомогенной реакции, по полученным данным рассчитала константы равновесий для 5-8 проб и определила значение свободной энергии Гиббса, 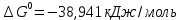 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
