дз. 5fan_ru_Определение константы скорости инверсии тростникового са. Лабораторная работа Определение константы скорости инверсии тростникового сахара (сахарозы)
 Скачать 185.5 Kb. Скачать 185.5 Kb.
|
|
Лабораторная работа: «Определение константы скорости инверсии тростникового сахара (сахарозы)» Цель работы: Ознакомиться с оптическим методом изучения кинетики реакции; определить порядок реакции по сахару и катализатору; определить средние константы скорости при заданной температуре; определить энергию активации реакции. Выполнение работы. С12Н22О12+Н2О→С6Н12О6+ С6Н12О6 Данная реакция является на практике реакцией 1го порядка. Это объясняется тем: второй реагент вода находится в таком количестве, что концентрация воды меняется незначительно. Благодаря этому, изменением концентрации воды можно пренебречь. Задание1. Температура опыта: 18°С Начальная концентрация кислоты С°кисл = 4н Начальная концентрация сахарозы С°сахароза= 0,378М ,ω = 12%. Время проведения опыта τ = 45 мин 30 сек. Для определения α∞ на водяную баню была помещена колба с раствором 15мл сахарозы и 15 мл 4н кислотыHCl. В течение 47 мин. раствор находился на бане при температуре около 50-67°С. По истечении этого времени установлено, что α∞= -1,78. Измерения для приготовленного раствора. Таблица 1, Результаты измерения
Ксред= 5,9*10-4сек-1 График 1, Зависимость lg(αt- α∞) = f(t). 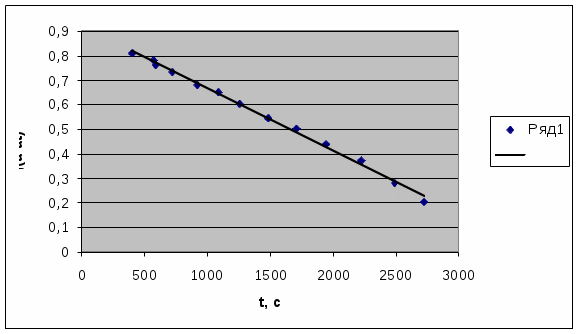 Экстраполируя полученную прямую (График 1) до t = 0 получаем, что α0=6,54. Учитывая это значение и полученное значение α∞, воспользуемся формулой (1) для расчета константы скорости реакции: 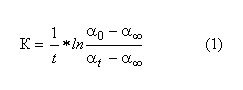 Задание2. Температура опыта: 28°С Начальная концентрация кислоты С°кисл = 4н Начальная концентрация сахарозы С°сахароза= 0,378М ,ω = 12%. Время проведения опыта τ = 46 мин 40 сек. α∞= -1,89 Таблица 2, Результаты измерений.
Ксред= 1,05*10-3сек-1 График 2 Зависимость lg(αt- α∞) = f(t). 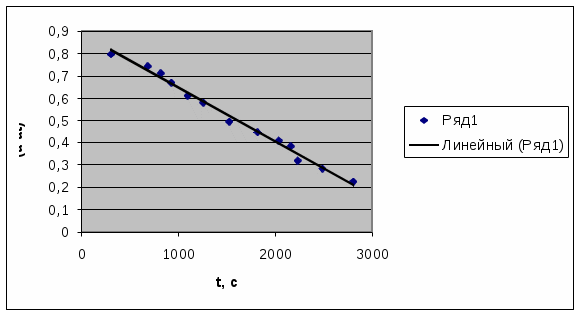 Экстраполируя полученную прямую (График 1) до t = 0 получаем, что α0=6,80. Учитывая это значение и полученное значение α∞, воспользуемся формулой (1) для расчета константы скорости реакции. Задание3. Вычисления энергии активации и температурного коэффициента. 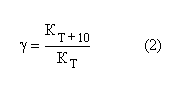 По уравнению (2) получаем, что γ=1,7. Задание 4. Вычисление энергии активации 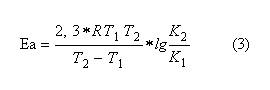 Подставляя полученные значения в уравнение (3), получим значение Еа= 38637,78 Дж/моль. |
