Скорость реакции. Лабораторная работа по дисциплине Химия (наименование учебной дисциплины согласно учебному плану) Тема работы Определение константы скорости реакции окисления иодида калия персульфатом аммония
 Скачать 133.79 Kb. Скачать 133.79 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования Санкт-Петербургский горный университет Кафедра физической химии ЛАБОРАТОРНАЯ РАБОТА По дисциплине Химия (наименование учебной дисциплины согласно учебному плану) Тема работы: Определение константы скорости реакции окисления иодида калия персульфатом аммония Выполнил: студент гр. МЦ-21-1 Баканов А.В. (шифр группы) (подпись) (Ф.И.О.) Дата: Проверил: (должность) (подпись) (Ф.И.О.) Санкт-Петербург 2022 Цель работы.Определить константу скорости реакции окисления иодида калия персульфатом натрия при заданных начальных концентрациях реагентов. Оборудование и реактивы: бюретка объемом 25 мл – 4 шт.; мерная пипетка объемом 5 мл (для крахмала) – 1 шт.; секундомер; колба круглая объемом 100 мл – 5 шт.; химический стакан объемом 50 мл – 5 шт; химический стакан объемом 25 мл (для персульфата) – 1 шт.; иодид калия – 0,2 М раствор; тиосульфат натрия – 0,02 М раствор; крахмал – 1 % раствор; персульфат натрия – 0,2 М раствор. Ход эксперимента.1. В каждую из 5 колб при помощи маркированных бюреток отмеряем порции растворов иодида калия, тиосульфата натрия и дистиллированную воду в количествах, указанных в таблице, согласно варианту 1. Мерной пятимиллилитровой пипеткой в каждую колбу отбираем порцию крахмала. Содержимое колб перемешиваем 2. В. маркированный химический стакан объемом 25 мл отмеряем указанный объем персульфата, согласно варианту. Выливаем в колбу с приготовленной реакционной смесью и одновременно включаем секундомер. 3. При появлении синего окрашивания секундомер останавливаем и записываем полученные данные Экспериментальные данные.1. Концентрация раствора иодида калия – 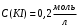 ; ;2. Концентрация раствора тиосульфата натрия–  ; ;3. Концентрация раствора персульфата натрия – 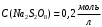 ; ;
Таблица 1. Экспериментальные данные Обработка экспериментальных данных
Таблица 2. Обработка экспериментальных данных Примеры вычислений. = =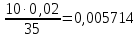 моль/л моль/л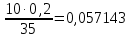 моль/л моль/л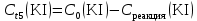 = =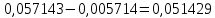 моль/л моль/л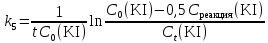 = =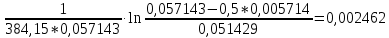 моль−1·л·с−1 моль−1·л·с−1Среднее значение константы скорости реакции:  0,0027528 моль−1·л·с−1 0,0027528 моль−1·л·с−1Вероятная ошибка определения средней константы скорости процесса: 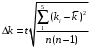 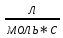 Для 95% константа Стьюдента t = 2,8. Значит ошибка:  Относительная погрешность:  Вывод.В ходе лабораторной работы была найдена константа скорости реакции окисления иодида калия персульфатом натрия: 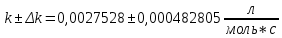 Относительная погрешность составляет 1,75%, что свидетельствует о точности данного метода определения. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

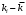 , моль−1·л·с−1
, моль−1·л·с−1 , моль−1·л·с−1
, моль−1·л·с−1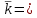 0,0027528
0,0027528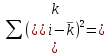 5,94644*10^-7
5,94644*10^-7