Лабораторная работа по химии Электролиз растворов электролитов студент гр. Зсуд420 Покровская Л. В
 Скачать 30.84 Kb. Скачать 30.84 Kb.
|
|
Министерство науки и высшего образования РФ Федеральное государственное бюджетное образовательное учреждение высшего образования «Владимирский государственный университет им. А.Г. и Н.Г. Столетовых» Кафедра химии Лабораторная работа по химии Электролиз растворов электролитов Выполнил: студент гр. ЗСуд-420 Покровская Л.В. Проверил: Кузурман В. А. Владимир, 2021 Лабораторная работа Электролиз Цель: изучить процесс электролиза, научится писать катодные и анодные реакции. Краткая теория Электролиз - окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного тока через раствор или расплав электролита. Электрод, соединённый с отрицательным полюсом источником тока, называют катодом, с положительным – анодом. На аноде протекают реакции окисления, на катоде – восстановления. Отрицательные ионы окисляются на аноде в определённой последовательности: S- , J-, Br- , Cl- ,OH- , (H2O), SO3 -2 ,NO2 - , SO4 -2, NO3 -, F- Последовательность восстановления ионов металлов зависит от положения металла в ряду напряжений и от концентрации их в растворе. В водных растворах на катоде может восстанавливаться также водород, если в растворе содержатся ионы щелочных и щелочноземельных металлов. Количество вещества на электроде рассчитывается по закону Фарадея m =Mэ/F*I*J или V= Vэ/F*I*J Приборы и реактивы: выпрямитель тока, магазин сопротивлений, амперметр, штатив, зажимы, сушильный шкаф, весы, образцы медной проволоки диаметром 2 мм., никелевый анод, электролит. Раствор электролита для никелирования: сульфат никеля 0,5 М, хлорид никеля 0,2 М, борная кислота 0,5 М. Раствор для обезжиривания: гидроксид натрия 0,5 М, карбонат натрия 0,25М, ортофосфат натрия 0,1М.Раствор для активации: серная кислота 0.1М.Растворы: хлорида натрия 0,1 М, сульфата натрия 0,1 М, сульфата меди (2) 0,1 М. Фенолфталеин, лакмус. Выполнение работы Опыт 1. Электролиз раствора хлорида натрия. Методика выполнения. Закрепить электролизер на штативе. Налить в неё 2/3 объёма раствора хлорида натрия. Вставить в оба отверстия трубки электроды и включить постоянный ток(4-6В). Электролиз вести 3-5 мин. После этого добавить в раствор к катоду несколько капель фенолфталеина, а в раствор к аноду несколько капель раствора иодида натрия.
*- имеется в виду тип процесса – окисление, восстановление, возгонка, сублимация и т.д. **- кислая, щелочная или нейтральная. Опыт 2.Электролиз раствора сульфата натрия. Методика выполнения. В электролизер налить раствор сульфата натрия. К электродам прилить несколько капель лакмуса. Включить ток и через 3-5 мин. Наблюдать изменение окраски электролита
*см. примечание к опыту 1. **см. примеч. К опыту 1. Опыт 3. Электролиз раствора сульфата меди(II) Методика выполнения. В электролизер налить раствор сульфата меди(II). Пропустить ток 5-10 мин. до появления заметного слоя розовой меди на катоде.
Опыт 4. Электролиз раствора сульфата меди(II) с использованием растворимого анода. Методика выполнения. Использовать электролизер с раствором после опыта 3. Переключить полюса электродов на клеммах источника тока. После этого электрод, который был катодом теперь будет являться анодом, а электрод, бывший анодом, будет катодом. Т. о., электрод, покрытый в предыдущем опыте медью, будет выполнять в данном опыте роль растворимого анодом. Электролиз проводить до полного растворения меди на аноде.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

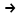 H2↑+2OH-
H2↑+2OH-