Лекция комплексные соединения. Лекция КС. Лекция 7 тема 3 химическая связь в комплексных соединениях (2 часа)
 Скачать 143.5 Kb. Скачать 143.5 Kb.
|
|
Раздел 2 ХИМИЧЕСКАЯ СВЯЗЬ Лекция 7 ТЕМА 3 ХИМИЧЕСКАЯ СВЯЗЬ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ (2 часа) Теории химической связи и комплексные соединения Метод валентных связей (ВС) теория кристаллического поля (ТКП). Метод молекулярных орбиталей (МО) Теории химической связи и комплексные соединенияРазвитие представлений о природе химической связи тесно связано с достижениями синтетической химии комплексных соединений, использованием современных физических и физико-химических методов исследования их строения. Богатый экспериментальный материал, полученный химиками-комплексниками, постоянно пополняемый все новыми соединениями (а начиная с 60-х годов нашего столетия каждый год синтезировалось несколько сот тысяч таких соединений) служил пробным камнем для проверки различных теорий химической связи. Метод валентных связей (ВС), в том числе и для комплексных соединений, исходит из положения, что химическая связь образуется за счет обобществления двух или большего количества электронов центральным атомом и одним из атомов, входящих в состав лиганда. При этом химические связи могут образовываться как по обычному механизму (А + В А:В), так и по донорно-акцепторному способу (А: + В А:В). Например, образование комплексного тетрафторобериллат-иона можно представить следующим образом: ВеF2 + 2F- BeF42- или Be2+ + 4F- BeF42- . Ион бериллия (2+) образует четыре гибридизированных sp3-орбитали, которые участвуют в образовании четырех -связей с четырьмя ионами F-. По координационной теории Вернера присоединение первых двух атомов фтора идет за счет главных валентностей, а последующих двух – за счет побочных валентностей. Метод ВС устраняет эти различия и делает ненужными понятия о главной и побочной валентностях. S- и р-элементы , а также с конфигурацией атомов d10s2 oбразуют комплексные соединения, в которых химические связи с центральным ионом-комплексообразователем реализуются за счет s-, p- и d-орбиталей внешнего электронного слоя. Например, в комплексном ионе AlCl4- (тетрахлороалюминат-иона) четыре связи образуются sp3- гибридизированными АО (а именно одна 3s и три 3р АО атома алюминия). Конфигурация этого иона – тетраэдрическая. В гексагидроксостаннат (IV) –ионе Sn(OH)62- - sp3d2 – гибридизация, он имеет октаэдрическую конфигурацию, в ионе тетраамминцинка Zn(NH3)42+ - sp3- гибридизация, и он является тетраэдром Сl OH NH3       HO OH HO OH  Al Sn Zn Al Sn Zn     C   l Cl HO OH NH3 NH3 l Cl HO OH NH3 NH3Cl OH NH3 В гибридизации могут принимать участие и неподеленные электронные пары. Например, комплексный ион-трихлоростаннат (II) SnCl3- имеет структуру незавершенного тетраэдра, один из углов которого занят неподеленной электронной парой. Следовательно, SnCl3- представляет собой трехгранную пирамиду с атомом олова в вершине и валентным углом СlSnCl, близким к тетраэдрическому. В то же время тетрахлоройодат (III) –ион JCl4- является плоским квадратом с атомом йода в центре, так как из шести sp3d2 – гибридизированных орбиталей, направленных к вершинам октаэдра, две, располагающихся вдоль одной из координатных осей, заняты двумя неподеленными электронными парами.   Sn       Cl Cl Cl Cl Cl Cl I  Cl Cl  Cl Cl Cl Cl В случае d-элементов в образовании связей в комплексных соединениях в рамках метода ВС могут принимать участие, кроме указанных выше АО, d-орбитали предвнешнего электронного слоя. При этом возможно два случая образования гибридизированных АО. Рассмотрим на примере комплексного иона, образованного центральным ионом Со3+ и шестью монодентантными лигандами L, образующими только -связи. Ион кобальта (III) имеет конфигурацию 3d6 (после потери трех электронов атомом кобальта с электронной конфигурацией 3d74s2). Каждый из шести лигандов представляет неподеленную электронную пару на свободные АО Со3+. Шесть гибридизированных АО могут образоваться за счет 4s-, трех 4р- и двух 4d- АО иона Со3+. Тип гибридизации будет обозначаться как sp3d2. Электроны на 3d-орбиталях Со3+ будут располагаться так же, как в свободном ионе Со3+, т.е. в соответствии с правилом Гунда. Это можно изобразить следующим образом: 3d 4s 4p 4d
 sp3d2 Комплекс будет парамагнитным, т.к. в нем имеются неспаренные электроны, его называют еще высокоспиновым комплексным соединением. Во втором случае шесть гибридизированных АО образуются за счет двух 3d-, одной 4s- и трех 4р- АО. Тип гибридизации – d2sp3, т.е. 3d 4s 4p 4d
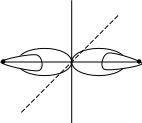
 d2sp3 При этом комплексный ион не содержит неспаренных электронов, он является диамагнитным и его называют низкоспиновым комплексным соединением. Энергия, необходимая для перестройки 3d-подуровня с размещением шести электронов на трех 3d-АО с освобождением двух 3d-АО, компенсируется за счет энергии образующихся донорно-акцепторных связей М-L. Очевидно, что возможность образования комплексов первого (с sp3d2 – гибридизацией) или второго (с d2sp3 – гибридизацией) типов будет определяться, в первую очередь, донорными свойствами лигандов. Так ацидолиганд F- (фтор – самый электроотрицательный элемент) будет весьма неохотно предоставлять одну из своих четырех неподеленных пар для образования донорно-акцепторных связей. Поэтому комплексный ион СоF63- будет являться высокоспиновым или его еще называют внешнеорбитальным. В то же время молекула аммиака (хотя бы вследствие меньшей электроотрицательности азота) более охотно дает свою неподеленную электронную пару для образования донорно-акцепторной связи. По этой причине комплексный ион Со(NH3)63+ будет являться низкоспиновым, его еще называют внутреннеорбитальным. По возрастанию своей донорной способности лиганды располагаются в так называемый спектроскопический ряд: J-Br-Cl-F-OH-H2ONH3enNO2-CN- . Комплексы с лигандами, примерно, до NH3 образуются по первому типу, а с NH3 и далее – по второму типу. Внешне- и внутреннеорбитальные комплексы, как правило, значительно отличаются по своей реакционной способности. Первые имеют весьма большие скорости образования и разрушения, их еще называют кинетически лабильными комплексами. Вторые характеризуются очень малыми скоростями образования и разрушения, их называют кинетически инертными комплексами. Метод ВС хорошо объяснял и прогнозировал пространственную конфигурацию комплексных ионов с относительно простыми лигандами. Но оказался несостоятельным при объяснении большинства физико-химических свойств комплексных соединений. Теория кристаллического поля (ТКП) Весьма плодотворной для объяснения магнитных, спектральных и ряда других свойств комплексов, в первую очередь, 3d-металлов оказалась теория кристаллического поля (ТКП). В ее основе лежит идея энергетического расщепления 3d подуровня (или частичного снятия вырождения 3d-орбиталей) в октаэдрическом, тетраэдрическом, квадратно-плоскостном и других полях лигандов. Р     асщепление обусловлено различными геометрическими свойствами d-орбиталей. Три из них, а именно dxy, dxz, dyz, располагаются между координатными осями асщепление обусловлено различными геометрическими свойствами d-орбиталей. Три из них, а именно dxy, dxz, dyz, располагаются между координатными осямиZ Y Z Y |
| изолированный ион ион 3d металла | ион в сферическом окружении лигандов | ион в октаэдричеком окружении лигандов | ион в тетраэдрическом окружении лигандов |
Рисунок 2.19. Расщепление 3d-орбитали в зависимости от геометрической конфигурации комплекса.
В изолированном (в вакууме) ионе 3d-металла все пять d-орбиталей имеют одинаковую энергию (они пятикратно вырождены). При попадании иона 3d-металла в сферическое окружение лигандов энергия всех пяти 3d АО повышается в одинаковой степени. Наконец, в октаэдрическом поле лигандов происходит расщепление 3d АО на две группы: нижнюю, имеющую более низкую энергию (dxy, dxz, dyz), и верхнюю с более высокой энергией (dx2-y2, dz2). Иначе говорят, что происходит частичное снятие вырождения 3d АО (3d-подуровня). Различия в энергии расщепленных подуровней носит название параметра расщепления и обозначается (конкретно для октаэдра окт).
 В тетраэдрическом окружении лигандов расщепление d-подуровня происходит по-другому. На рис.2 изображены 3dхz и 3dx2-y2 орбитали в тетраэдрическом окружении. Z
В тетраэдрическом окружении лигандов расщепление d-подуровня происходит по-другому. На рис.2 изображены 3dхz и 3dx2-y2 орбитали в тетраэдрическом окружении. Z
 Z
Z 




X X




 dxz d x2-y2
dxz d x2-y2Рисунок 2.20. Орбитали 3dхz и 3dx2-y2 в тетраэдрическом окружении
В отличие от октаэдра ни одна из групп d АО непосредственно не взаимодействует с электрическими полями лигандов. Но орбиталь dxz (аналогично dxy, dyz), проходя через середины ребер куба, располагается ближе к лигандам (половина длины ребра куба), а орбиталь dx2-y2 (аналогично dz2), проходя через середины граней куба, дальше от лигандов (половина диагонали грани куба). Поэтому первая группа d-орбиталей (dxy, dxz, dyz) испытывает большее воздействие со стороны электрических полей лигандов и становится энергетически менее выгодной по сравнению со второй группой (dx2-y2, dz2). Таким образом, характер расщепления d-подуровня в тетраэдре становится обратным по сравнению с октаэдром (рис.1). Но параметр расщепления тетр. меньше, чем окт . При прочих равных условиях тетр = 4/9 окт (для одного и того же иона металла и одних и тех же лигандов), что вполне понятно, ибо в тетраэдре в отличие от октаэдра отсутствует непосредственное взаимодействие 3d АО с электрическими полями лигандов.
Электроны, попадая на нижнюю группу расщепленных d-орбиталей, стабилизируют комплекс. Имеет место выигрыш энергии, получивший название энергии стабилизации (Ест) кристаллическим полем. Общее количество этой энергии будет равно произведению Ест на количество электронов, размещенных на этой группе d-орбиталей. Попадание электронов на верхнюю группу d-орбиталей, наоборот, будет дестабилизировать комплекс.
Характер распределения электронов по расщепленным d-подуровням зависит от значения параметра расщепления и энергии П, необходимой для размещения двух электронов на одной орбитали с преодолением сил межэлектронного отталкивания. Если расщепление мало (П), то электроны занимают d-орбитали по одному, в том числе и верхнюю группу d АО. Если параметр расщепления большой, т.е. П, то электроны первоначально полностью заполняют нижнюю группу d-орбиталей (по два на каждой d АО). Например, в октаэдрическом комплексном ионе СоL63+, образованном центральным ионом Со3+ с конфигурацией 3d6 (смотри выше), характер распределения электронов по расщепленным d-подуровням для первого (1) и второго (II) случаев будет выглядеть, соответственно:

I II
Рисунок 2.30. Расщепление 3d6 подуровня и распределение электронов на нем в зависимости от типа лигандов
Параметр расщепления, в первую очередь, зависит от природы лиганда и по возрастанию лиганды располагаются в спектроскопический ряд:
J-Br-Cl-F-OH-H2ONH3enNO2-CN-.
Лиганды, расположенные слева, примерно до NH3, носят название лигандов слабого поля. Комплексы с этими лигандами, например СоF63-, имеют конфигурацию типа 1, они являются высокоспиновыми и, соответственно, парамагнитными. В комплексных ионах с лигандами правее NH3 электроны распределяются по расщепленным d-АО по типу II, например Со(NH3)63+. Эти комплексы являются низкоспиновыми и диамагнитными. Так как тетр. почти вполовину меньше окт., то для тетраэдрических комплексов П и эти комплексы, как правило, являются высокоспиновыми и парамагнитными.
Параметр расщепления соответствует по энергии видимой части спектра (=h). По этой причине большинство комплексов 3d-металлов являются окрашенными, что дает возможность определять величину из оптических данных или прогнозировать окраску различных комплексов этих элементов. Изменение энергии стабилизации комплексных ионов кристаллическим полем по мере заполнения электронами расщепленных d АО хорошо объясняет, например, изменение устойчивости комплексов по ряду 3d-металлов в одинаковой степени окисления центрального иона.
Однако при переходе к комплексам с большим вкладом -связей, что характерно для комплексов 4d-, 5d-, 4f-элементов, ТКП становится малоэффективной. Это связано с тем, что этот подход учитывает только расщепление 3d-орбиталей под действием электростатического поля лигандов. При этом последние рассматриваются как точечные заряды или диполи.
Метод молекулярных орбиталей (МО)
Наиболее общим и универсальным подходом к объяснению электронного строения комплексных соединений является метод молекулярных орбиталей (МО). Другое название метода МО применительно к комплексам – теория поля лигандов.
Рассмотрим применение метода МО для объяснения электронного строения комплексного иона, образованного центральным ионом Со3+ и шестью монодентантными лигандами (L), дающими только -связь Со3+-L. В линейных комбинациях с образованием МО со стороны иона Со3+ принимают участие одна 4s-, три 4р- и пять 3d-орбитали, а со стороны лигандов – шесть одинаковых по энергии -орбиталей, расположенных вдоль координатных осей х, у и z.
На рис.4 изображены 4s-АО Со3+ и шесть -орбиталей лигандов L. Учитывая, что 4s-орбиталь имеет один и тот же знак волновой функции по всему объему, возможны две линейных комбинации исходных орбиталей. z


5


 4 4
4 4 1
3




 х
х 
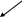
у
2
6
Рисунок 2.31. Комбинация 4s АО центрального иона и шести - орбита лей лигандов с образованием s связующей МО
Первая приводит к образованию связующей s молекулярной орбитали с энергией, меньшей, чем исходные АО. Вторая комбинация дает разрыхляющую S молекулярную орбиталь с энергией, большей чем исходные АО.
На следующем рис. 2.5 приведены 4рх орбиталь Со3+ и две -орбитали лигандов 1 и 3, которые могут комбинироваться с 4рх АО.
Рисунок 2.32. Комбинация 4рх АО
Z
- - X
-
3 1
центрального атома и двух
-орбиталей лигандов с
образованием р связующей МО
Знак плюс дает связывающую МО, а знак минус разрыхляющую. Аналогично для 4ру и 4рz:
При этом связующие МО р (рх, ру и рz) и, соответственно, разрыхляющие МО *p (*pх, *pу, *pz) будут энергетически равноценными.
Из пяти 3d АО иона Со3+ к линейной комбинации с -орбиталями лигандов способны только 3dХ2-У2 и 3dZ2. В соответствии с рис.6 для 3dХ2-У2 возможны две комбинации (+ и -*):
Таким образом, образуются по две одинаковых по энергии связывающие МО - d (dZ2 и dХ2-У2) и разрыхляющие МО - *d (*dZ2 и *dХ2-У2).
Орбитали 3dху, 3dxz и 3dуz не способны к линейной комбинации с -орбиталями лигандов, так как расположены в разных областях пространства атома Со. Поэтому они переходят в комплексный ион практически без изменения и носят названия несвязывающих МО (несв).
 Z
Z






 Z
Z 































Рисунок 2.33. Комбинация 3dX2-Y2 и 3dZ2 АО центрального иона с -орбиталями лигандов с образованием связующих d МО
Энергетическая диаграмма МО комплексного иона СоL63+ может изображена (рисунок 2.7).
Распределение 18 электронов (6 -у иона Со3+ и 12 – у шести лигандов) по МО происходит следующим образом. В первую очередь заполняется нижняя группа связывающих МО, а именно s, p и d, вмещающая 12 электронов, оставшиеся 6 электронов распределяются между dнесв и *d МО. Характер заполнения этих МО определяется различием в энергиях dнесв и *d. Эта разница обозначается и носит название параметра расщепления, как в теории кристаллического поля. Соотношение между величинами и П и положение лигандов в спектроскопическом ряду (см. теорию кристаллического поля) и определяет распределение электронов между несв и *d.

 *p
*p
 *S
*S


4
 p
p  4S
4S 










3








 d σнесв
d σнесв



 d
dИ


 сходные p Исходные АО
сходные p Исходные АОАО Со3+ 1 шести лигандов L
 s
s МО СоL6
МО СоL6Рисунок 2.34. Энергетическая диаграмма МО комплексного иона СоL63+
На рисунке 2.35. изображена энергетическая диаграмма для фторидного комплекса кобальта (III) – СоF63- (фторид-ион лиганд слабого поля) и аммиачного комплекса кобальта (III) – Со(NH3)63+ (NH3 –лиганд сильного поля)
*s
*p
 *d
*d 





 несв
несв 


 d
d 




 р
р 
 s
s МО СоF63- МО Со(NH3)63+
Рисунок 2.35. Энергетическая диаграмма для фторидного комплекса кобальта (III) – СоF63- и аммиачного комплекса кобальта (III) – Со(NH3)63+
Таким образом, комплексный ион – гексафторокобальтат (III), будет высокоспиновым, парамагнитным, а комплексный ион – гексаамминкобальт (III) будет низкоспиновым, диамагнитным.
Существенно отметить, что и метод ВС, и ТКП лишь частично описывают энергетическую диаграмму комплексов МL6. Три нижних группы МО дают нам тип гибридизации sp3d2 (квадрат 1 на рис.2.7 ), а ТКП - только несв и d* МО (квадрат II на рис.2.7).
Контрольные вопросы
1. Известно, что из раствора комплексной соли СоСl3 6NH3 нитрат серебра (1) осаждает весь хлор, а из раствора СоСl3 5NH3 только 2/3 хлора. Исходя из этого напишите координационные формулы обоих соединений и уравнения их диссоциации.
2. Какое основание является более сильным: Сu(OH)2 или [Cu(NH3)4](OH)2 ?
3. Какая кислота сильнее НСN или Н[Ag(CN)2] ? Почему ?
4. Степень гидролиза какой соли больше: ZnCl2 или [Zn(NH3)4]Cl2 ? КСN или К[Ag(CN)2] ?
5. Какой комплексный ион должен иметь большее значение константы нестойкости: а)[Zn(NH3)4]2+ или [Cd(NH3)4]2+; б)[Co(NH3)4]2+ или [Co(NH3)6]3+; в)[Fe(CN)6]3- или [Fe(CN)6]4- ?
6. Какой комплексообразователь должен давать более прочные комплексы при одинаковых лигандах: а) Рt4+ или Рt2+; б) Са2+ или Zn2+; в) Мg2+ или Ni2+; г) Zn2+ или Сd2+ ?
7. Определите геометрическое строение комплексных ионов. Какого типа гибридные орбитали комплексообразователя участвуют в образовании связей с лигандами: [Co(NH3)6]3+; [Co(NH3)6]2+; [Ti(H2O)6]3+; [Mn(CN)6]3-; [NiF6]4-; [Pt(NH3)4]2+ ?
8. Константа нестойкости иона [Cd(CN)4]2- составляет 7,8 10-18. Вычислить концентрацию ионов кадмия в 0,1 М растворе К2[Cd(CN)4], содержащем в избытке 0,1 моля КСN в литре раствора.
9. Напишите уравнения реакций в молекулярном и ионно-молекулярном видах:
а
 ) [Cu(NH3)4](OH)2 + H2S
) [Cu(NH3)4](OH)2 + H2S б
 ) Na[Al(OH)4] +NH4Cl
) Na[Al(OH)4] +NH4Clв
 ) [Ag(NH3)2]NO3 + NaNO2
) [Ag(NH3)2]NO3 + NaNO2 
 X dxz dxy dyz
X dxz dxy dyz 

 Y Z
Y Z



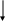






 окт тетр
окт тетр
