ДО лекц метод баланса. Метод электронного баланса
 Скачать 4.43 Mb. Скачать 4.43 Mb.
|
Метод электронного баланса.Окислительно-восстановительные уравнения можно уравнять с помощью метода электронного баланса. Уравнение взаимодействия металлического алюминия с расплавленной смесью селитры и щелочи составляют в следующем порядке: 1. Записывают молекулярную схему процесса: Al + KNО3 + КОН К3А1О3 + NH3 ↑ 2. Проводят электронный баланс для окислителя: +5 -3 N + 8е=N 3. Проводят электронный баланс для восстановителя: 0 +3 А1 - Зе=А1 4. Коэффициенты в общем молекулярном уравнении перед окислителем и его восстановленной формой равны числу электронов, теряемых атомом-восстановителем, а коэффициенты перед восстановителем и его окисленной формой — числу электронов, присоединяемых атомом-окислителем:
Коэффициенты находят как множители, уравнивающие электронный баланс окислителя и восстановителя. Число молекул КОН определяют по числу атомов калия в правой части за вычетом числа его атомов в левой части уравнения (24 - 3). Число полученных молекул Н2О равно половине разности числа атомов водорода, содержащихся в КОН (21) и входящих в аммиак (9), т. е. (21 - 9) : 2 = 6. 5. Проверку правильности коэффициентов в уравнениях окислительно-восстановительных реакций с участием кислородсодержащих веществ осуществляют при помощи кислородного баланса: суммарное число атомов кислорода в левой и правой частях уравнения должно быть одинаковым. Электролиз расплавов и растворов солей  Электролизу подвергаются расплавы и растворы электролитов – солей и щелочей. При электролизе химическая реакция осуществляется за счет энергии электрического тока, например: электролиз раствора хлорида меди. 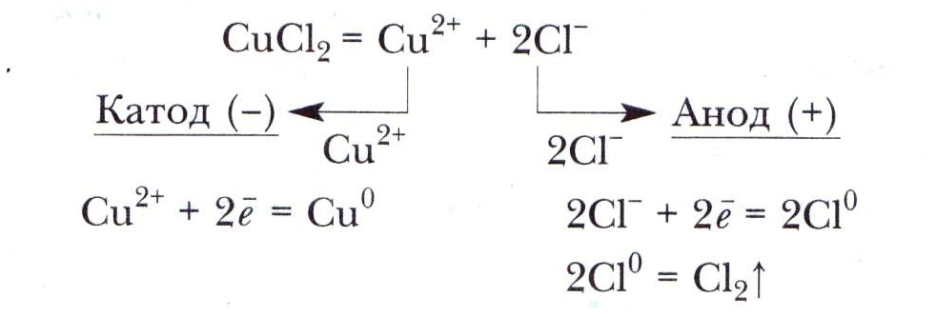 На катоде восстанавливается медь, на аноде выделяется хлор.      Определение продукта, образующегося на КАТОДЕ, при помощи электрохимического ряда напряжений металлов.  Определение продукта, образующегося на АНОДЕ, при помощи ряда напряжений ионов.  Упражнения Составьте уравнения реакций электролиза растворов: Хлорида ртути Хлорида магния Йодида натрия Нитрата меди (II) Хлорида цинка |
