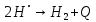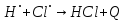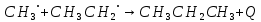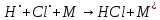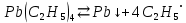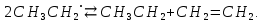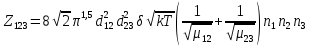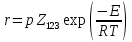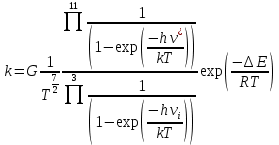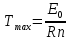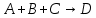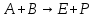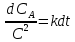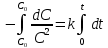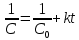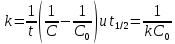Реферат на тему: Методы исследования элементарных констант реакций рекомбинации и диспропорционирования радикалов. реферат. Методы определения элементарных констант скоростей реакций рекомбинации и диспропорционирования радикалов
 Скачать 85.31 Kb. Скачать 85.31 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РФ Федеральное государственное автономное образовательное учреждение высшего образования «СЕВЕРО-КАВКАЗСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ» ХИМИКО-ФАРМАЦЕВТИЧЕСКИЙ ФАКУЛЬТЕТ КАФЕДРА ОРГАНИЧЕСКОЙ И АНАЛИТИЧЕСКОЙ химии Доклад по курсу дисциплины «Методы исследования механизмов органических реакций» на тему: «Методы определения элементарных констант скоростей реакций рекомбинации и диспропорционирования радикалов» Работу выполнил: студент IV курса, ХФФ, группа ХИМ-б-о-18-1 Бобров Анатолий Анатольевич Проверил: кандидат химических наук Щербаков Станислав Владимирович Ставрополь, 2021 ОГЛАВЛЕНИ ВВЕДЕНИЕ 3 Особенности протекания реакций рекомбинации и диспропорционирования радикалов. 4 Математический аппарат 8 Определение констант скорости радикальных реакций в газовой фазе 10 Измерение констант скорости радикальных реакций в жидкой фазе 14 ЗАКЛЮЧЕНИЕ 19 СПИСОК ЛИТЕРАТУРЫ 20 ВВЕДЕНИЕИзмерение констант скорости представляет фундаментальный интерес, во-первых, для выяснения общих принципов реакционной способности и, во-вторых, для определения механизмов реакции. Это обусловливает актуальность темы. Константы скорости оцениваются путем наблюдения за скоростью, с которой концентрация любого реагента или продукта реакции изменяется со временем, используя любой подходящий параметр, который является мерой концентрации. Поэтому целью данной работы является изучение методов измерения концентраций радикалов и рассмотрение математической обработки получаемых результатов. Для достижения указанной цели мы решаем следующие задачи: 1. Объяснить поведение констант реакций рекомбинации и диспропорционирования радикалов при изменении температуры, показать особенности их протекания. 2. Изучить математическую модель реакций третьего и второго порядков. 3. Описать известные методы измерения концентрации свободных радикалов в жидкой и газообразной фазах. Особенности протекания реакций рекомбинации и диспропорционирования радикалов.Свободные радикалы - частицы, содержащие один или несколько неспаренных электронов на внешней электронной оболочке, в то время как молекулы имеют четное число электронов, следовательно, цепная реакция свободных радикалов может быть прекращена только в реакции, в которой участвует четное число радикалов, то есть реакция между двумя радикалами, а не реакция радикала и молекулы. Реакция двух радикалов может привести либо к одной молекуле путем комбинации (часто называемой рекомбинацией) двух радикалов, либо к двум молекулам путем переноса атома водорода или электрона от одного радикала ко второму, процесс, который называется диспропорционированием, а иногда и трансмутацией. Под реакцией рекомбинации радикалов принято понимать процесс, обратный гомолитическому разрыву связей. Рекомбинация связана с образованием ковалентной связи за счёт обобществления неспаренных электронов, принадлежащих разным частицам (атомам, свободным радикалам):
Реакция рекомбинации сильно экзотермична, для неё характерна очень малая или нулевая энергия активации. Поэтому такие реакции протекают с участием третьей нейтральной частицы, которая уносит энергию реакции:
Где М – частица до взаимодействия, М* - частица с избыточной энергией. Принято записывать реакцию следующим образом:
Диспропорционирование радикалов – перераспределения атомов и их группировок, принадлежащих двум одинаковым или разным радикалам (не стоит путать с обычными реакциями диспропорционирования). Например, этильный радикал 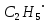 , полученный при термическом разложении тетраэтилсвинца Pb(C2H5)4: , полученный при термическом разложении тетраэтилсвинца Pb(C2H5)4:
существует всего доли секунды, причѐм исчезает он не только за счѐт соединения двух свободных радикалов друг с другом с образованием н-бутана:
но и вследствие отрыва свободным радикалом этилом атома водорода от метильной группы другой частицы свободного радикала этила; в результате получаются предельный и непредельный углеводороды - этан и этилен:
Аналогичные процессы могут протекать и между разными свободными радикалами. Диспропорционирование свободных радикалов - реакция второго порядка, которая может осуществляться по циклическому механизму. Скорость процесса увеличивается с ростом числа атомов H, находящихся в β-положении к неспаренному электрону, и только в случае третбутильного радикала превышает скорость рекомбинации [1]. В газовой фазе тройные соударения маловероятны. Однако существуют некоторые превращения, в которых подобный механизм реализуется. Это, прежде всего, те, в которых для образования стабильных продуктов необходима передача выделяющейся энергии. Таковыми являются реакции рекомбинации радикалов. Характерной особенностью тримолекулярных реакций при больших значениях температуры является уменьшение константы скорости с ростом температуры. Рекомбинация и диспропорцинирование радикалов - процессы, для протекания которых энергия активации не нужна. Посмотрим, как две основные теории химической кинетики могут объяснить наблюдаемые опытные факты. Обе теории предполагают статистически равновесное распределение энергии, для которого нужны столкновения, не приводящие к реакции между молекулами. Энергия активации тримолекулярных реакций мала или просто равна нулю. Равновесное распределение поступательной энергии устанавливается благодаря тому, что частота тройных соударений (10–36 – 10–33 см6/с) много меньше, чем двойных (10–11–10–10 см3/с). Именно в двойных соударениях, в том числе и одинаковых молекул между собой, будет устанавливаться равновесное распределение. По ТАС число тройных соударений равно:
Скорость реакции определится выражением:
Если принять диаметр молекулы 3Å, толщину шарового слоя 1Å, массу молекулы в среднем 30D, то при 300К получим Z = 1,5*1010л2/моль2с-1, что близко к значению предэкспоненты для некоторых реакций рекомбинации радикалов водорода, брома и йода с участием третьей частицы, взаимодействия радикала 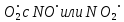 . Но для многих взаимодействий совпадение расчетных экспериментальных данных достигается только после введения стерического множителя порядка 10–7 , что трудно объяснить с точки зрения рассматриваемой теории (использование представления о невыгодной ориентации при ударе не может дать такой поправки). . Но для многих взаимодействий совпадение расчетных экспериментальных данных достигается только после введения стерического множителя порядка 10–7 , что трудно объяснить с точки зрения рассматриваемой теории (использование представления о невыгодной ориентации при ударе не может дать такой поправки).Качественно уменьшение значения  с ростом температуры может быть обусловлено тем, что диаметр молекул может уменьшаться с ростом температуры, что учитывается поправкой Сазерленда. В этом случае, при той же энергии взаимодействия кривая потенциала Сазерленда или ветвь притяжения потенциала Леннарда - Джонса должны быть круче, а толщина шарового слоя δ, входящая в формулы ТАС, с ростом температуры будет меньше. Однако часто мы не умеем определять энергию взаимодействия, входящую в поправку Сазерленда. с ростом температуры может быть обусловлено тем, что диаметр молекул может уменьшаться с ростом температуры, что учитывается поправкой Сазерленда. В этом случае, при той же энергии взаимодействия кривая потенциала Сазерленда или ветвь притяжения потенциала Леннарда - Джонса должны быть круче, а толщина шарового слоя δ, входящая в формулы ТАС, с ростом температуры будет меньше. Однако часто мы не умеем определять энергию взаимодействия, входящую в поправку Сазерленда.Кроме того, следует учесть, что критерием состояния соударения является условие: энергия взаимодействия двух молекул должны быть больше kT. С ростом температуры расстояние между частицами (толщина шарового слоя) на котором будет выполняться это условие, будет уменьшаться. Однако количественных совпадений достичь трудно. Лучшее совпадение получается при использовании ТАК. Для тримолекулярной реакции константа скорости будет выражаться как
Здесь  – вырожденность первого электронного уровня соответствующей молекулы и АК – вырожденность первого электронного уровня соответствующей молекулы и АКОбъединим все независящие от температуры сомножители в множитель  . Тогда . Тогда
Понятно, что при малой энергии активации значение константы скорости будет падать с ростом температуры. В рамках этой теории можно получить хорошее совпадение опытных и расчетных величин. При этом необходимо учесть возможность внутреннего вращения в активированном комплексе. При понижении температуры зависимость k от Т должна иметь максимум. Для определения значения температуры в точке максимума продифференцируем
по Т. Здесь пренебрегаем зависимостью колебательных сумм по состояниям от температуры и 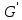 есть произведение есть произведение  и колебательных сумм. Из условия равенства нулю производной находим, что: и колебательных сумм. Из условия равенства нулю производной находим, что:
Если значение энергии активации будет составлять несколько кДж/моль, максимум должен наблюдаться при низких температурах: например, при 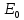 = 3 кДж/моль и = 3 кДж/моль и = 7/2 получим = 7/2 получим  = 103,1К. Поэтому в опытах обычно не замечают максимума и говорят только об уменьшении константы скорости тримолекулярной реакции с ростом температуры [2]. = 103,1К. Поэтому в опытах обычно не замечают максимума и говорят только об уменьшении константы скорости тримолекулярной реакции с ростом температуры [2].Математический аппаратКак было указано выше, реакции рекомбинации проходят как реакции третьего порядка, где третьим компонентом является либо растворитель, либо газ (основной компонент системы). Реакции диспропорционирования идут как реакции второго порядка. Рассмотрим в общем виде реакции третьего порядка:
Если 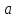 , ,  и и 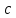 – начальные концентрации реагентов – начальные концентрации реагентов 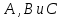 соответственно их – уменьшение этих концентраций за время соответственно их – уменьшение этих концентраций за время  , то дифференциальное кинетическое уравнение имеет вид: , то дифференциальное кинетическое уравнение имеет вид:
где 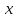 – изменение концентрации компонентов – изменение концентрации компонентов  и и 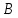 , , 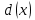 - изменение концентрации основного компонента. Так как величина - изменение концентрации основного компонента. Так как величина 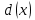 очень мала для радикальных реакций, то можно принять очень мала для радикальных реакций, то можно принять  , постоянную величину принято вносить в константу, которая будет разной для различных газов и жидкостей. Далее будем рассматривать указанные выше процессы как бимолекулярные реакции. , постоянную величину принято вносить в константу, которая будет разной для различных газов и жидкостей. Далее будем рассматривать указанные выше процессы как бимолекулярные реакции.Реакции второго порядка в общем виде можно записать как:
Или
Для упрощения математических расчетов примем, что в последнем случае до начала реакции
Тогда
или
Интегрируем в пределах от начала реакции  ( (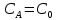 ) до времени ) до времени  , когда концентрация , когда концентрация  : :
Если начальные концентрации исходных веществ  различны и равны, соответственно различны и равны, соответственно  , то для расчета констант скорости реакций второго порядка в этом случае применяют уравнение: , то для расчета констант скорости реакций второго порядка в этом случае применяют уравнение:
Если нам известны значения концентраций в моменты времени  и и  , то мы можем легко вычислить величину константы скорости реакции второго порядка. За тем можно использовать это уравнение для расчета концентраций реагирующего вещества в интересующий нас момент времени. Зависимость 1/Cот , то мы можем легко вычислить величину константы скорости реакции второго порядка. За тем можно использовать это уравнение для расчета концентраций реагирующего вещества в интересующий нас момент времени. Зависимость 1/Cот  представляет собой прямую линию. представляет собой прямую линию.Если зависимость 1/с от времени линейна и период полупревращения обратно пропорционален исходной концентрации, то это реакция второго порядка [4]. Для реакции второго порядка, считая концентрации исходных веществ равными, кинетическое уравнение запишется выражением:
Откуда
Для реакций второго порядка наблюдается линейная зависимость величины обратной концентрации от времени. Зная концентрацию радикалов в различные моменты времени, можно составить линейную зависимость обратной концентрации от времени. Далее уже находится сама константа скорости. Концентрацию радикалов определяют различными методами, универсального способа не существует. Было выяснено, что реакции рекомбинации и диспропорционирования радикалов идут как 2 параллельные реакции. Это значительно упрощает расчет констант. Так, уменьшение концентрации радикалов идет со скоростью, равной удвоенной сумме констант реакций диспропорционирования и рекомбинации; эти константы относятся как выходы реакций диспропорционирования и рекомбинации. Составляя систему уравнений, можно отдельно найти эти константы. Поэтому задача исследователя сводится к измерению концентраций радикалов в некоторые моменты времени и замеру концентраций полученных продуктов. Определение констант скорости радикальных реакций в газовой фазеЕсли реагент или продукт поглощает электромагнитное излучение в УФ-видимой области спектра, поглощение может использоваться для измерения концентрации радикалов. Это составляет суть метода УФ-спектроскопии, применяющего закон Ламберта-Берра:
где  и и 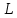 -интенсивности падающего и проходящего света, -интенсивности падающего и проходящего света, 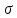 –молярный коэффициент поглощения, –молярный коэффициент поглощения, 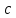 -концентрация, а -концентрация, а 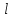 -длина оптического пути. Многие представляющие интерес частицы поглощают в удобных спектральных областях, например, -длина оптического пути. Многие представляющие интерес частицы поглощают в удобных спектральных областях, например,  при 308 нм, при 308 нм,  при 662 нм, алкильные и алкилпероксидные радикалы при 200-300 нм. Источники УФ -видимого света и системы обнаружения легко доступны. При условии, что молярный коэффициент поглощения при 662 нм, алкильные и алкилпероксидные радикалы при 200-300 нм. Источники УФ -видимого света и системы обнаружения легко доступны. При условии, что молярный коэффициент поглощения 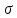 известен, то УФ-видимость дает абсолютное измерение концентрации свободных радикалов. У него есть два существенных ограничения. Во-первых, чувствительность метода ограничена измерением небольшого изменения (поглощения) в большом количестве (проходящий свет). Во-вторых, могут возникнуть осложнения, поскольку на длине волны исследования могут поглощать более одной частицы, например, алкилпероксидные радикалы часто имеют максиму поглощения при 200-300 нм, однако продукты их реакции также могут поглощать в одной и той же области спектра. известен, то УФ-видимость дает абсолютное измерение концентрации свободных радикалов. У него есть два существенных ограничения. Во-первых, чувствительность метода ограничена измерением небольшого изменения (поглощения) в большом количестве (проходящий свет). Во-вторых, могут возникнуть осложнения, поскольку на длине волны исследования могут поглощать более одной частицы, например, алкилпероксидные радикалы часто имеют максиму поглощения при 200-300 нм, однако продукты их реакции также могут поглощать в одной и той же области спектра.Другим способом измерения концентрации радикалов является метод резонансной флуоресценции. Атом, переведенный в возбужденное состояние быстрым электроном, должен потерять свою избыточную энергию либо в результате излучения, либо в результате дезактивации при столкновении. Химическое разложение невозможно, а переход энергии в тепловое движение маловероятен. Таким образом, при достаточно низких давлениях наблюдается излучение для всех типов атомов. Простейшим типом флуоресценции является резонансная флуоресценция, при которой излучаемое излучение имеет ту же длину волны, что и падающее излучение. Резонансная флуоресценция чаще всего наблюдается в видимом или ультрафиолетовом диапазоне, где спонтанное излучение максимально. При прохождении через плазму молекулярные частицы диссоциируют на атомы, которые затем возбуждаются ударом ускоренного электрона и испускают излучение, характерное для рассматриваемого атома. Это излучение используется в качестве источника света для измерения концентрации атомов в кинетических экспериментах. Частота этого света находится в резонансе с частотой, необходимой для возбуждения атомов основного состояния в их первое возбужденное состояние. Затем возбужденные атомы теряют энергию (в масштабе наносекунд), испуская свет во всех направлениях. Эта флуоресценция регистрируется перпендикулярно падающему возбуждающему излучению с помощью фотоумножительной трубки. Резонансная флуоресценция - это чувствительный, избирательный и простой метод измерения концентрации радикалов. Предполагая, что рассеянный свет от возбуждающего источника света сведен к минимуму и фоновый сигнал практически отсутствует, методы флуоресценции более чувствительны, чем спектроскопия поглощения. Лазерно-индуцированная флуоресценция аналогична резонансной флуоресценции, но более универсальна, чем резонансная флуоресценция. Электронно-возбужденный радикал находится в определенном вращательном и колебательном состоянии. Возбужденный радикал может затем возвратиться в основное состояния за счет флуоресценции. Флуоресценция может иметь ту же длину волны, что и источник возбуждения (резонансная флуоресценция), или она может иметь несколько большую длину волны. Метод очень чувствителен и избирателен. Чувствительность этого метода зависит от мощности лазерных источников. Однако интенсивное падающее излучение иногда может приводить к нежелательным эффектам из-за поглощения света другими частицами в газовых смесях. Например,  поглощается в той же области, что и радикалы поглощается в той же области, что и радикалы 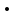 OH. Если О3 облучается на длинах волн менее 320 нм, то озон вступает в реакцию с водяным паром, образуя радикалы OH. Если О3 облучается на длинах волн менее 320 нм, то озон вступает в реакцию с водяным паром, образуя радикалы 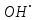 . Таким образом, возбуждающее излучение может нарушить химическую систему. Лазерно-индуцированная флуоресценция является методом количественного обнаружения радикалов . Таким образом, возбуждающее излучение может нарушить химическую систему. Лазерно-индуцированная флуоресценция является методом количественного обнаружения радикалов 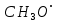 (303,9, 375 нм), (303,9, 375 нм), 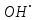 (282, 308 нм), (282, 308 нм), 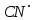 (388, 422 нм) и (388, 422 нм) и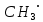 (431, 431 нм) кинетика реакции (значения в скобках-типичные длины волн возбуждения и флуоресценции ). (431, 431 нм) кинетика реакции (значения в скобках-типичные длины волн возбуждения и флуоресценции ).Полостная кольцевая спектроскопия - новый кинетический метод, при котором лазерный импульс вводится в стабильный оптический резонатор. Кинетические данные получают путем измерения увеличенной скорости затухания лазерного излучения, вызванного поглощением в полости переходными видами свободных радикалов. Метод электронного спинового резонанса (ЭПР) или электронного парамагнитного резонанса широко использовался в течение десятилетий для исследования атомов, свободных радикалов и молекул, имеющих неспаренный электрон. Применение магнитного поля к частицам, имеющим неспаренный электрон, приводит к расщеплению энергетических уровней, соответствующих различной ориентации по отношению к магнитному полю. Разница в уровнях энергии пропорциональна напряженности магнитного поля. Поглощение электромагнитного излучения, обычно в микроволновой области, может вызвать переход между этими двумя состояниями. На практике частота микроволнового излучения поддерживается постоянной, а магнитное поле изменяется. Основное преимущество ЭПР заключается в том, что он может обнаруживать любые парамагнитные частицы. Абсолютная концентрация может быть получена путем сравнения интенсивностей с интенсивностями известных стандартов, таких как 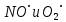 . .Лазерный магнитный резонанс является разновидностью ЭПР и применяется в различных газокинетических экспериментальных системах. Метод основан на сдвиге уровней энергии магнитным полем, эффекте Зеемана. Настройка уровней молекулярной энергии путем приложения определенной напряженности магнитного поля приводит к перекрытию с частотой лазера. Затем лазерное поглощение может быть использовано для измерения концентрации с использованием закона Ламберта-Берра. Самым большим преимуществом является его высокая чувствительность. Ограничения метода заключаются в том, что разделение энергетических уровней относительно невелико, так что частота лазера должна быть точно подобрана в отсутствие магнитного поля. Лазерный магнитный резонанс может использоваться только для обнаружения ограниченного числа радикалов, например,  и триплетного метилена. и триплетного метилена.Масс-спектрометры являются чувствительными универсальными детекторами, широко применяемыми в кинетических экспериментах в газовой фазе, и могут использоваться для обнаружения различных частиц, особенно более стабильных молекул. Иногда бывает трудно контролировать атом и свободные радикалы из-за соображений времени отбора проб, а также фрагментации исходных молекул во время возбуждения электронным ударом. Большим преимуществом обнаружения масс-спектрометрии является высокая чувствительность и способность четко различать различные пути реакции, дающие различные продукты. Измерение констант скорости радикальных реакций в жидкой фазеДля радикалов в растворе наиболее часто используемым свойством является оптическое поглощение; но измерения проводимости, парамагнитного резонанса, полярографии и микроволнового поглощения, хотя и менее широко используемые, могут и дают необходимую информацию для расчета констант скорости реакции. Изобретение и разработка методов импульсного радиолиза и фотолиза со вспышкой с быстрым временным разрешением предоставили мощные средства для создания различных радикалов в растворе и измерения скорости их взаимодействия друг с другом и с растворенными веществами, что, в свою очередь, приводит к образованию других радикалов. Рассмотрим методы определения констант скорости на основе исходных экспериментальных наблюдений, включая их преимущества и ограничения, факторы, которые необходимо учитывать, такие как температура, рН и ионная сила, вероятные источники ошибок и подводные камни, которых следует избегать. Основной акцент сделаем на методы, которые обеспечивают абсолютные значения констант скорости. В методах импульсного радиолиза и импульсного фотолиза с оптической регистрацией свет от непрерывного источника проходит через реакционную камеру, обычно в направлении, перпендикулярном импульсу излучения или световой вспышке, которая генерирует радикалы. Образование радикалов и их последующая реакция затем контролируются по изменению интенсивности проходящего света через реакционную ячейку в зависимости от времени с использованием подходящих фотодетекторов. Каждый метод имеет свои преимущества и недостатки, но часто конкретные измерения, которые нелегко выполнить с помощью одного метода, легче достичь с помощью другого, поэтому эти два метода дополняют друг друга. Отличительными особенностями радиолиза и фотолиза являются процессы, посредством которых энергия поглощается в растворе. В разбавленном растворе, который обычно представляет интерес, ионизирующее излучение поглощается в основном растворителем, так что первичные радикалы являются радикалами растворителя, каким бы ни было растворенное вещество. При фотолизе условия выбираются таким образом, чтобы свет, как правило, поглощался растворенным веществом для образования выбранных первичных радикалов. во-первых, длина волны фиксируется, и скорость реакции оценивается по скорости изменения поглощения со временем. Во втором случае фиксируется время измерения и изменяется длина волны, чтобы получить спектральные изменения поглощения, которые происходят по мере протекания реакции и которые помогают пролить свет на ход реакции. Также возможно комбинировать оба режима работы с помощью детекторов, таких как диодные матрицы и полосовые камеры, которые могут одновременно измерять изменения поглощения в диапазоне длин волн. Таким образом, как кинетическая, так и спектральная информация может быть получена из одного импульса излучения или световой вспышки [5]. Многие свободные радикалы не обнаруживаются или их очень трудно обнаружить в водном растворе. Двухатомные радикалы, такие как 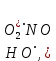 просто не обнаруживаются в водном растворе комнатной температуры из-за их очень большой ширины линий и чрезвычайно низких концентраций в стационарном состоянии. Кроме того, большинство сероцентрированных радикалов, таких как тиильный радикал глутатиона (GS·), также имеют очень широкие линии, что делает их обнаружение возможным только при очень низких температурах. Для преодоления такого рода проблем была разработан метод спинового захвата (спиновых ловушек). просто не обнаруживаются в водном растворе комнатной температуры из-за их очень большой ширины линий и чрезвычайно низких концентраций в стационарном состоянии. Кроме того, большинство сероцентрированных радикалов, таких как тиильный радикал глутатиона (GS·), также имеют очень широкие линии, что делает их обнаружение возможным только при очень низких температурах. Для преодоления такого рода проблем была разработан метод спинового захвата (спиновых ловушек).Спиновый захват включает реакцию присоединения интересующего свободного радикала к диамагнитному соединению, спиновой ловушке, с получением относительно стабильного свободного радикала (спинового аддукта), который накапливается в концентрации, достаточно высокой для изучения ЭПР. Нитроксиды относительно стабильны, потому что неспаренный электрон резонансно стабилизирован. Спиновые ловушки не легко реагируют с резонансно-стабилизированными радикалами и, следовательно, мало помогают в повышении их видимости; однако резонансно-стабилизированные радикалы легче всего наблюдать непосредственно с помощью ЭПР. Таким образом, спиновый захват является ценным инструментом для изучения свободнорадикальных процессов:
Существует два основных класса спиновых ловушек: нитроновые и нитрозосоединения:   Рисунок 1. Нитрозосоединение и нитрон Нитрозосоединения предоставляют значительно больше информации, чем нитроны, поскольку улавливаемый радикал присоединяется непосредственно к азоту, тем самым увеличивая объем информации в сверхтонких слоях. Пример реакции захвата:
Нитроны являются наиболее популярными спиновыми ловушками из-за стабильности как ловушки, так и получаемого аддукта. Показан пример реакции захвата нитрона:
Спиновый захват широко используется из-за способности обнаруживать образование радикалов в режиме реального времени в водных растворах комнатной температуры. Многие из интересующих радикалов можно было наблюдать только непосредственно в замороженном растворе, поэтому можно было наблюдать только моментальные снимки текущих процессов.  Рисунок 2. Наиболее используемые спиновые ловушки. Спиновый захват является интегративным. Поскольку время жизни спинового аддукта обычно намного больше, чем у исходного радикала, его концентрация намного больше, что делает удобным обнаружение радикалов [6, 7]. ЗАКЛЮЧЕНИЕВ работе мы рассмотрели различные методы определения констант рекомбинации и диспропорционирования радикалов. Ни один из этих методов не является универсальным, приходится выбирать метод, наиболее подходящий в данной ситуации. Мы подробно рассмотрели кинетические уравнения. Хотя они не являются точными, однако этого достаточно, чтобы описать реакции диспропорционирования и рекомбинации при их параллельном протекании с удовлетворительной точностью. Константы реакции – наиболее простой способ описания реакции в разбавленных растворах и газовых смесях. Численные значения констант позволяют судить о механизме реакции или подтвердить его при наличии уже существующих доказательств (например, изотопный эффект, константы Гаммета). Поэтому исследования в данном направлении актуальны и ведутся в настоящее время. СПИСОК ЛИТЕРАТУРЫ1.https://www.studmed.ru/pankratov-a-n-disproporcionirovanie-organicheskih-soedineniy-reakcii-protekayuschie-s-perenosom-gidrid-iona-ionnoe-gidrirovanie-superkisloty-i-superosnovaniya-metatezis-alkenov_89ed1c65e8b.html 2. http://www.chem.msu.ru/rus/teaching/kubasov/10.pdf 3. Семиохин И. А., Физическая химия: Учебник. М: Изд-в МГУ, 2001. 272 с. 4. Афанасьев Б. Н., Акулова Ю. П., Физическая химия: Учебное пособие. СПб.: Издательство «Лань», 2012. 464 с 5. Alfassi Z.B. (ed.) The Chemistry of Free Radicals Series, Great Britain: Bookcraft, 1999, 563 p. 6. https://labrador-expert.ru/wp-content/uploads/2018/10/Spinovye-lovushki-v-biologii-i-meditsine.pdf 7. Филиппов А. К., Кинетика и механизм элементарных стадий полимеризации с обратимой передачей цепи: изучение методом спиновой ловушки : автореф. дис. … к. х. н.: 02.00.06 / Филлиппов Анатолий Николаевич - Москва, 2013. -166 с. |