ЛР электрохимический эквивалент меди. Методические рекомендации по выполнению лабораторной работы. 3 Теоретические сведения и методические рекомендации по выполнению лабораторной работы
 Скачать 71.13 Kb. Скачать 71.13 Kb.
|
|
Лабораторная работа Определение электрохимического эквивалента меди 1 Цель работы Определить электрохимический эквивалент меди при проведении электролиза раствора сульфата меди. 2 Средства обучения2.1 Лабораторное оборудование: источник постоянного тока, электролитическая ванна, раствор сульфата меди, медные электроды, наждачная бумага, ключ, амперметр, соединительные провода, реостат. 2.2 Методические рекомендации по выполнению лабораторной работы. 3 Теоретические сведения и методические рекомендации по выполнению лабораторной работы Электролиты это вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся кислоты, основания и соли. Электролиз – это физико-химический окислительно-восстановительный процесс, протекающий в растворах или расплавах электролитов под действием электрического тока, заключающийся в выделении на электродах составных частей растворённых веществ или других веществ - продуктов вторичных реакций на электродах. Процесс на катоде K(-): катион принимает электроны и восстанавливается. Процесс на аноде A(+): анион отдает электроны и окисляется. Примером электролиза растворов может служить электролиз медного купороса (рисунок 1), молекулы которого подвергаются электролитической диссоциации: 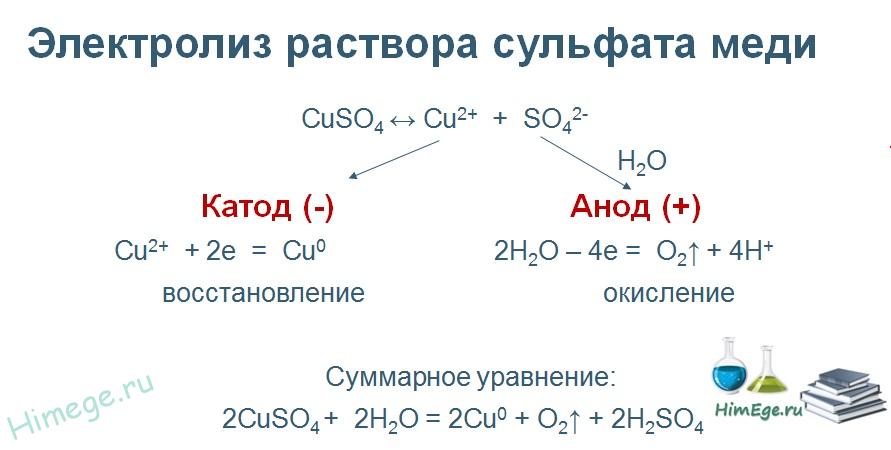 Рисунок 1-Электролиз раствора сульфата меди. Электролитическая диссоциация - это процесс распада электролита на ионы при его растворении или плавлении. Количественно электролиз описывается законами Фарадея: Масса выделяющегося на электроде вещества пропорциональна количеству электричества, протекающего через раствор: 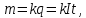 (1) (1)где k-электрохимический эквивалент,  , I- сила тока, протекающего через раствор, А, t- время электролиза (с), q- количество электричества, Кл. , I- сила тока, протекающего через раствор, А, t- время электролиза (с), q- количество электричества, Кл.Для выделения на электроде 1 эквивалента любого вещества необходимо затратить одно и то же количество электричества, равное числу Фарадея:F =NA.e= 96500 Кл /моль. 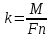 , (2) , (2)где k-электрохимический эквивалент, кг/Кл, М - молярная масса, кг/моль, n- валентность, F- число Фарадея Кл/моль,  – химический эквивалент, кг/моль. – химический эквивалент, кг/моль.Физический смысл k Электрохимический эквивалент численно равен отношению массы иона к его заряду. Электролиз применяется в электрометаллургии для получения редких металлов, для очистки металлов от примесей, в гальваностегии - покрытие одного металла тонким слоем другого, в гальванопластике - получение копий рельефных деталей, в медицине – электрофорез. Электролиты подчиняются закону Ома. Сопротивление электролитов при повышении температуры уменьшается, так как при повышении температуры увеличивается доля молекул, распавшихся на ионы, и поэтому увеличивается число ионов - носителей заряда. 4 Задание 4.1 Провести электролиз раствора сульфата меди. 4.2 Определить электрохимический эквивалент меди. 5 Ход выполнения лабораторной работы 5.1 Зачистите наждачной бумагой медный электрод и измерьте его массу с точностью до 0,01 г. 5.2 Соберите схему по рисунку 2. Присоедините медные электроды к источнику постоянного тока (электрод с известной массой - к катоду), опустите электроды в стакан с раствором сульфата меди.  Рисунок 2- Схема опыта. 5.3 Включите секундомер одновременно с источником тока. Установите и поддерживайте силу тока 0,5 А в течение всего времени электролиза (время электролиза 10 минут). 5.4 По окончании электролиза отключите источник тока, отсоедините катод, промойте его в воде и высушите в потоке теплого воздуха. 5.5 Охладите катод до комнатной температуры и определите его массу после электролиза. 5.6 Результаты опыта и вычислений занесите в таблицу. Таблица 1-Результаты измерений и вычислений
5.7 Вычисления: 5.7.1 Вычислите массу меди, выделившуюся на катоде: 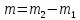 5.7.2 Вычислите электрохимический эквивалент по формуле 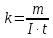 5.7.3 Вычислите абсолютную погрешность электрохимического эквивалента меди 𝛥k= 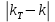 (для меди kт = 3,29.10-7 кг/Кл) (для меди kт = 3,29.10-7 кг/Кл)5.7.4Вычислите относительную погрешность электрохимического эквивалента меди ε =  5.8 Сделайте вывод. В выводе укажите истинное значение k в виде 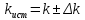 и физический смысл электрохимического эквивалента. и физический смысл электрохимического эквивалента. 5.9 Ответьте на контрольные вопросы. 6 Контрольные вопросы 6.1 Что такое электролитическая диссоциация? Объясните причину возникновения заряженных частиц в растворе электролита. Какие частицы являются носителями тока в электролитах? 6.2 Какие вещества называют электролитами? Приведите примеры. 6.3 Какой процесс называют электролизом? Где применяется электролиз? Какие явления происходят на катоде при подключении установки для электролиза к источнику питания? Какие явления происходят на аноде? 6.4 Сформулируйте законы электролиза. 6.5 Почему с повышением температуры сопротивление электролита уменьшается? |
