Оператор по искуственному осеменению. Оператор по искусственному осеменению животных и птицы
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
Министерство сельского хозяйства РФФедеральное государственное бюджетное образовательное учреждение высшего образования «Ульяновский государственный аграрный университет имени П. А. Столыпина» Колледж агротехнологий и бизнеса Кафедра «Хирургия, акушерство, фармакология и терапия» ОТЧЕТ о прохождении учебной практики ПМ.05 Выполнение работ по одной или нескольким профессиям рабочих, должностям служащих «Оператор по искусственному осеменению животных и птицы» Выполнила: обучающаяся 3 курса Специальность: 36.02.01 Ветеринария Квалификация: ветеринарный фельдшер Хасанова Дарья Александровна Проверила:__________ г. Ульяновск 2022 г. Министерство сельского хозяйства РФ Федеральное государственное бюджетное образовательное учреждение высшего образования «Ульяновский государственный аграрный университет имени П. А. Столыпина» Колледж агротехнологий и бизнеса УлГАУ Кафедра «Хирургия, акушерство, фармакология и терапия» ИНДИВИДУАЛЬНОЕ ЗАДАНИЕ по учебной практике ПМ.05 Выполнение работ по одной или нескольким профессиям рабочих, должностям служащих «Оператор по искусственному осеменению животных и птицы» Специальность 36.02.01 Ветеринария Уровень подготовки базовый Квалификация выпускника - ветеринарный фельдшер Форма обучения очная______________________________________________ Обучающаяся 3 курса Хасанова Дарья Александровна Сроки прохождения практики с 6 июня по 18 июня 2022 г. Форма предоставления на кафедру выполненного задания письменный вариант Дата выдачи задания 6 июня 2022 г. Руководитель практики: к.в.н., старший преподаватель Иванова С.Н. ___________ 1.Изучение техники безопасности при работе с сельскохозяйственными животными. 2. Изучение анатомо-топографических особенностей полового аппарата самок. 3.Ознакомление и проведение ректального исследования коров с целью определения физиологического состояние половых органов самок. 4.Освоение техники введения внутриматочных средств и тампонов во влагалище 5.Осовением и проведение диагностики скрытого мастита у коров. 6.Освоение техники безопасности труда при работе с сосудом Дьюара. 7.Осовоение технологии оттаивания и подготовки семени к применению. 8.Освоение методики приготовления растворов разной концентрации. 9.Освоение методов обеззараживания посуды, инструментов и других материалов, используемых при искусственном осеменении животных и птиц. 10.Освоение техники искусственного осеменения животных и птицы, применяемой в хозяйстве. С заданием ознакомлен (на) _______________________(подпись) Содержание Введение…………………………………………………………………………..5 Лист ежедневной работы………………………………………………………...6 1.Техника безопасности при работе с сельскохозяйственными животными...8 2.Анатомо-топографические особенности полового аппарата самок………...9 3.Ректальное исследование коров с целью определения физиологического состояние половых органов самок……………………………………………...12 4.Введение внутриматочных средств и тампонов во влагалище……………..14 5.Диагностика скрытого мастита у коров……………………………………...16 6.Техника безопасности труда при работе с сосудом Дьюара………………..17 7.Технология оттаивания и подготовки семени к применению……………...19 8.Организация пункта искусственного осеменения животных на молочных фермах……………………………………………………………………....……21 9.Методы обеззараживания посуды, инструментов и других материалов, используемых при искусственном осеменении животных и птиц……23 10.Методики приготовления растворов разной концентрации……………….25 Список использованной литературы…………………………………………...29 Проверка на оригинальность……………………………………………………31 Введение С 06 июня 2022 года по 18 июня 2022 года я проходила учебную практику «Оператор по искусственному осеменению животных и птицы». Целью учебной практики является приобретение и объединение теоретических знаний, практических умений. Ниже приведены темы, которые я изучила и освоила: Техника безопасности при работе с сельскохозяйственными животными; Анатомо-топографические особенности полового аппарата самок Ректальное исследование коров с целью определения физиологического состояния половых органов самок; Введение внутриматочных средств и тампонов во влагалище; Диагностика скрытого мастита у коров; Техника безопасности труда при работе с сосудом Дьюара; Технология оттаивания и подготовки семени к применению; Организация пункта искусственного осеменения животных на молочных фермах; Методы обеззараживания посуды, инструментов и других материалов, используемых при искусственном осеменении животных и птиц; Методики приготовления растворов разной концентрации. Лист ежедневной работы обучающегося.
1.Техника безопасности при работе с сельскохозяйственными животными Заходить в помещение, где находятся животные, следует только в халате, чепчике и рабочей обуви. При входе и выходе с территории фермы обязательно смачивать подошвы с обуви на дез.барьере или дез.коврике. Перед подходом к животному необходимо его окликнуть, обращаться с ним ласково повелительно, но не грубо. Категорически запрещается наносить животному болевые ощущения. Не становиться в направлении ударов животного следует быть предельно внимательным, постоянно следить за положением головы, рогов и конечностей животного. Приводить в рабочее положение измерительные инструменты необходимо на определенном расстоянии от людей и животных. Не следует очень близко подходить к работающим шнекам, транспортерам, прицепам и другим установкам. После посещения фермы необходимо тщательно вымыть руки с мылом. При возникновении несчастного случая необходимо оказать помощь пострадавшему и сообщить о случившемся преподавателю [1]. Подгон коров следует осуществлять с помощью средств, исключающих ответную реакцию животных (хлопушки, погонялки и прочее). Перед началом доения корова должна быть хорошо зафиксирована. При ручном доении следует соблюдать осторожность, учитывая возможность травмирования конечностями и хвостом. Подготовка вымени к доению не должна вызывать у животных неприятных ощущений. При отвязывании и привязывании коров, содержащихся на индивидуальных привязях, и при ручной раздаче подкормки нельзя наклоняться к голове коровы. При ветеринарных обработках голову коровы следует фиксировать носовыми щипцами, а конечности – различными подручными средствами [1,2]. 2.Анатомо-топографические особенности полового аппарата самок Половые органы самок делятся на наружные и внутренние. К наружным относятся промежность, вульва, преддверие влагалища, клитор. К внутренним: влагалище, шейка матки, тело матки, рога матки, яйцепроводы, яичники (рис.1). 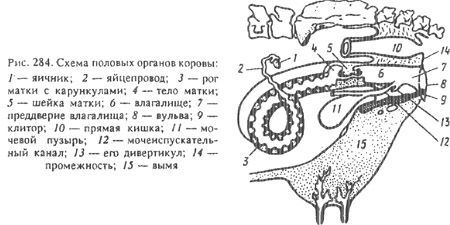 Рисунок 1. Схема половых органов коровы Яичники - это парный орган, в организме самок они выполняют три важнейшие функции: 1) генеративную (воспроизводящую) — вырабатывают женские половые гаметы посредством овогенеза (фолликулогенеза); 2) эндокринную (гормональную), т.е. выполняют роль железы внутренней секреции — воспроизводят женские половые гормоны (эстрогены); 3) образуют временную железу внутренней секреции — желтое тело, производящее прогестерон и релаксин. Вульва состоит из половых губ и имеет потовые и сальные железы. У лошадей вентральный угол закруглен, дорзальный заострен, а у коров, овец, коз и свиней наоборот — дорзальный закруглен, вентральный заострен. У самок крупного рогатого скотаклитор образован двумя длинными кавернозными телами. Возле клитора располагаются слаборазвитые малые преддверные железы, в боковых стенках преддверия — большие преддверные железы (бартолиниевы железы), открывающиеся одним протоком с каждой стороны. Мочеполовой клапан развит слабо. Гарт-неровы ходы открываются двумя отверстиями вблизи уретры. У входа в мочеиспускательный канал имеется дивертикул [3]. Преддверие влагалища представляет собой мускульную трубку, переходящую краниально во влагалище, а каудально заканчивающуюся половой щелью. На границе с влагалищем на нижней стенке имеется отверстие мочеиспускательного канала. По бокам преддверия влагалища расположены два пещеристых тела, которые во время коитуса наполняются кровью, что вызывает утолщение половых губ. Длина влагалища — до 30 см. Верхний свод влагалища хорошо развит. Влагалище-это орган совокупления и выводной канал шейки матки. Стенка влагалища состоит из слизистой оболочки и двух слоев гладкой мускулатуры. Слизистая оболочка не имеет желез, она собрана в большое количество складок. Матка состоит из шейки, тела и рогов. Шейка матки хорошо развита, имеет длину 8—12 см, резко обособлена со стороны как матки, так и влагалища. Задняя часть шейки матки выступает в полость влагалища на 2-4 см и называется влагалищной частью шейки матки. Слизистая оболочка образует малые продольные и крупные поперечные складки, направленные своими вершинами в сторону влагалища. Шейка матки соединяет просвет влагалища с маткой, в ней имеются железы, которые вырабатывают слизь, увлажняющую влагалище. Особенно много слизи вырабатывается в период полового цикла. В шейке матки, имеется сфинктер, плотно закрывающий просвет, поэтому она всегда закрыта и открывается только во время течки, родов, в послеродовый период, а также при воспалении матки. Матка двураздельная (тело матки маленькое 2-3 см). Рога матки постепенно переходят в яйцепроводы. Слизистая оболочка имеет карункулы (материнскую плаценту), расположенные в каждом роге в четыре ряда по 10-14 в каждом ряду. Всего карункулов от 80 до 120. Ка-рункулы имеют вид полукруглых образований и выпуклую форму. Располагается матка в тазовой полости. При переходе тела матки в рога отчетливо заметна межроговая борозда. Яйцепроводы извиваются слабо. Расширенная часть короткая. Бахромка развита слабо. Длина яйцепроводов до 30 см. Они отходят от рогов матки и заканчиваются воронкообразным расширением в нижней части яичников. На слизистой оболочке яйцевода находится цилиндрический мерцательный эпителий, реснички которого колеблются в сторону матки. В стенке яйцевода имеется мышечный слой, обеспечивающий перистальтические сокращения. Наличие перистальтики мерцательного эпителия обеспечивает продвижение яйцеклетки или зиготы в рог матки. Яичники имеют овальную форму, их размер — 3,5 х 2 х 2 см, они покрыты зачатковым эпителием. Фолликулы и желтые тела выступают на поверхности яичников и легко пальпируются при ректальном исследовании. Яичники располагаются на дне тазовой полости у верхушки рогов матки. Подвешены яичники в брюшной полости на яичниковой связке: левый — под четвертым-пятым поясничным позвонком, правый — под третьим-четвертым Кровоснабжение половых органов осуществляется за счет трех пар маточных артерий (передней, средней и задней), которые имеют диагностическое значение при ректальном исследовании на стельность[3,4]. 3.Ректальное исследование коров с целью определения физиологического состояние половых органов самок Для проведения ректального исследования необходимо подготовить как животное, так и специалиста. Ветеринар должен коротко остричь ногти, заровнять их пилкой, обработать порезы, ранки, гнойничковые поражения раствором йода. Руки моются с мылом между каждой диагностикой, необходимо пользоваться теплой водой. Исследование проводится в специальной полиэтиленовой одноразовой перчатке, а также лучше надеть фартук и манжету на рукав. Руку в перчатке увлажняют по локоть теплой водой, а на кончики пальцев наносят вазелиновое масло, мыло или крем. Захватив другой рукой хвост и отведя его в сторону, приступаем к исследованию: 1.Буравящими движениями продвигаем пальцы в прямую кишку; 2.Раздвигаем их для проникновения воздуха в толстый кишечник – это спровоцирует дефекацию; 3.После осторожно продвигаем руку вглубь, при необходимости извлекая каловые массы; 4.Для диагностики необходимо просунуть кисть через ампуловидное расширение; 5.Сразу за ним идет сужение прямой кишки и можно уже приступить к изучению небеременной матки; 6.Для диагностики других органов руку следует продвинуть чуть дальше (рис.2).  Рисунок 2. Ректальное исследование Все манипуляции следует проводить крайне осторожно и только в периоды расслабления (отсутствие перистальтики) [5]. Ветеринарный врач в момент изучения органов брюшной и тазовой полостей должен быть крайне осторожен. Разрывы прямой и толстой кишок частое явление. Пытаясь двигать рукой в момент сокращений, мы лишь провоцируем их усиление. Нужно соблюдать технику безопасности, чтобы предупредить заболевания у животного и обезопасить себя от заражения. Моменты расслабления стенок кишечника периодические и удлиняются с каждой фазой. За время их наступления фельдшер может определить состояние органов. Для этого рукой через кишку ощупывают поверхность, при необходимости захватывая мелкие элементы (яичник). Изучение необходимо проводить подушечками пальцев, а не их концами – там больше нервных окончаний и ниже риск травмы ногтями. После подготовительного этапа наиболее удобно изучать шейку и тело матки. В бесплодном состоянии, а также большую часть беременности она находится в тазовой полости и легко обнаруживается в виде плотного упругого тяжа. Она сравнительно легко обнаруживается при смешениях руки в стороны по дну таза. Ее отсутствие сообщает о наличие патологического состояния или о поздних месяцах стельности. После обследования тела органа необходимо найти место бифуркации или раздвоения. Далее поочередно изучают каждый рог матки. В конце необходимо обследовать яичники. Для их обнаружения ладонь помещают на участок разделения рогов, а пальцы должны «свисать» между ними. Теперь, смещая руку к тазу движениями в стороны, находят плотный объект величиной с яйцо, такой же формы. На нем можно выявить фолликулы, кисты[6]. 4. Введение внутриматочных средств и тампонов во влагалище Существуют различные способы введения лекарственных средств, каждый из которых по-своему эффективен и быстр по своему действию. При этом любой из способов введения препарата животному требует определенных знаний и соблюдения ряда правил. Многие лекарственные препараты, использующиеся при лечении гинекологических заболеваний и воспалении матки у коров, такие как, Каротил, Пеноцефур,Утерофур вводятся внутриматочно. Методики правильного введения таких препаратов коровам внутриматочного, так как их соблюдение позволяет существенно повысить эффективность лечения. Перед применением внутриматочного препарата следует провести санитарную обработку наружных половых органов и корня хвоста коровы. Для этого можно использовать антисептический раствор, а также обыкновенную теплую воду с мылом, с помощью которых обмывают и промывают наружные половые органы. Затем из прямой кишки вручную удаляют фекальные массы. После этого снова проводят санитарную обработку наружных половых органов и корня хвоста [6,7]. В случае воспаления полость матки очищают от воспалительного экссудата. При этом вручную максимально освобождают полость матки от экссудата путем массажа матки через прямую кишку по направлению от верхушки рогов матки к влагалищу в течение 2-3 минут с интервалом 48 часов. При наличии большого количества экссудата, часто при интоксикации, экссудат и омертвевшие ткани удаляют промыванием полости матки теплым раствором хлорида натрия, соды, йода, фурацилина или перманганата калия. Для этого в шприц Жане набирают чистый теплый промывочный раствор, заливают в матку и легко массажируют матку через прямую кишку по направлению от верхушки к телу матки, добиваясь освобождения полости матки от раствора. Только после того, как из матки начнет выходить чистый промывочный раствор, в матку можно помещать свечи, таблетки и другие лекарственные средства. Однако перед непосредственным введением препарата необходимо снова провести санитарную обработку наружных половых органов и корня хвоста теплым мыльным раствором. Свечи и таблетки вводят в полость матки рукой, одетой в одноразовую перчатку. При использовании мазей, суспензий и эмульсий порядок действий таков: вначале, используя одноразовые перчатки, ректально вручную фиксируют шейку матки коровы. Затем соединяют шприц с лекарственным средством с катетером, и осторожно вводят катетер под углом 30 градусов во влагалище, избегая попадания в наружное отверстие уретры. После горизонтально направляют его до наружной части шейки матки, постепенно вводя в шейку матки, и выдавливают содержимое шприца в полость матки. Таким образом, лекарственный препарат равномерно распределяется по матке [6,8]. Ректо-вагинальный метод внутриматочного лечения требует твердой руки специалиста для успешного введения лекарственного средства и во избежание механических повреждений наружных половых органов и матки. При введении вагинального тампона также проводится туалет наружных половых органов. Далее при помощи длинного пинцета ватно-марлевый тампон, обильно смоченный лекарственным средством вставляем во влагалище. Через 3-4 часа вытаскиваем тампон за тесенку. 5.Диагностика скрытого мастита у коров Для профилактики маститов и предупреждения получения молока низкого качества необходимо своевременно проводить диагностические исследования. По клиническим признакам маститы у коров подразделяют на серозный, катаральный, фиброзный, гнойный и геморрагический. Скрытый мастит диагностируют путем исследования молока с одним из быстрых диагностических тестов -БМТ, используя при этом пробу молока с димастином, мастидином или Милкотестом (рис.3). Действие быстрых маститных тестов основано на выявлении увеличенного количества лейкоцитов и изменения рН молока. А также, отстаиванием на мастит[8,9]. При исследовании в луночки пластинки от каждой доли вымени наливают по 1 мл молока последней порции удоя, добавляют по 1 мл Милкотеста. Содержимое луночки перемешивают стеклянной палочкой. Молоко, полученное от коров, больных маститом, образует плотный тягучий сгусток ярко-красного цвета. Если образуется сгусток желеподобной консистенции красного цвета, то считают, что молоко получено от коров, подозрительных по заболеванию маститом. Нормальное молоко остается однородным, цвет его оранжево-красный.  Рисунок 3. Милкотест 6. Техника безопасности труда при работе с сосудом Дьюара При искусственном осеменении животных используют сперму, замороженную при -196°, которую хранят в жидком азоте в сосудах Дьюара. Специалист, работающий с сосудами Дьюара и жидким азотом, обязан надевать защитные очки, а лучше щитки из органического стекла, перчатки или рукавицы. Одежда должна быть без карманов, брюки без манжет и закрывать верх обуви. Рукавицы должны быть свободными, чтобы при необходимости их можно было легко сбросить. При попадании жидкого азота на кожу пораженный участок немедленно обильно обмыть водой. Помещение, где работают с жидким азотом или хранят сосуды Дьюара, должно быть оборудовано приточно-вытяжной принудительной вентиляцией, которое обеспечивает содержание кислорода в воздухе не менее 19%. Обращаться с сосудами Дьюара необходимо осторожно, в строгом соответствии с инструкцией по их эксплуатации. При падении, ударах, резких толчках может произойти нарушение целостности наружного кожуха или внутреннего сосуда, что сопровождается потерей вакуума. Признаком такой неисправности является быстрое испарение жидкого азота и обледенение наружного кожуха. Эксплуатировать и отогревать в рабочих помещениях неисправные сосуды Дьюара категорически запрещается. Потерявший вакуум сосуд Дьюара надо освободить от хранимой спермы и жидкого азота, а затем поставить на отогревание в течение 3 суток в помещение, куда запрещен доступ людей. Закрывать сосуды Дьюара можно только предназначенными для них крышками. Запрещается плотно закрывать горловину сосуда. Испарение части жидкого азота создает внутри сосуда избыточное давление, поэтому внутрь сосуда не может попасть кислород из наружного воздуха. Кроме того, повышение давления создает опасность повреждения сосуда или выброса жидкого азота[9]. При транспортировке сосуды Дьюара и находящиеся рядом предметы необходимо надежно закреплять во избежание падений, повреждений. Заливать жидкий азот в сосуд Дьюара надо через гибкий металлорукав диаметром 18 мм, давление по манометру в транспортной цистерне должно быть не более 0,5 атм. Гибкий металлорукав должен быть опущен в сосуд до дна, чтобы струя азота не выбросила рукав из горловины, так как могут пострадать работающие рядом люди. Из сосуда Дьюара и сосуд заливку ведут через широкую металлическую воронку. В процессе заливки категорически запрещается заглядывать в сосуд для определения уровня жидкости. Заправка считается законченной при появлении из горловины первых брызг жидкости. Особую осторожность следует соблюдать во время заполнения теплых сосудов Дьюара, то есть новых или отогретых. Заполнять сосуды Дьюара жидким азотом в одиночку запрещается. Вводить пинцет, канистры и другие предметы в жидкий азот надо медленно во избежание разбрызгивания, вызванного «кипением» жидкости при контакте с теплыми предметами. Чтобы сперма всегда находилась в жидком азоте, сосуды Дьюара, предназначенные для ее хранения, периодически дозаправляют, при понижении уровня жидкого азота до половины емкости сосуда. Контроль за уровнем азота проводят периодическим погружением в азот металлической или деревянной линейки. Жидкий азот как более летучий компонент обогащается кислородом примесью и техническом продукте. Недопустимо в смеси свыше 15% жидкого кислорода, так как такая смесь может воспламениться при контакте с органическими продуктами. При отсутствии газоанализатора после каждых 12 дозаправок жидкость из сосуда Дьюара сливают, сосуд заполняют свежим азотом. Слив проводят на открытой специальной площадке в безопасном месте. Вблизи мест слива не должно быть деревьев, бумаги, асфальта и других органических продуктов [8,9]. 7.Технология оттаивания и подготовки семени к применению При работе с замороженной спермой необходимо строго придерживаться правила: нельзя допускать преждевременного размораживания семени и замораживать его повторно. Для того, чтобы оттаять семя потребуется термостат или водяная баня, а также термометр, анатомический пинцет длиной 25-30 см, таймер или часы с секундной стрелкой, термо-пенал и шприц-катетер для искусственного осеменения (рис.4,5).   Рисунок 5. Инструменты для ИО Рисунок 4. Термостат После тщательной очистки рук и рабочей поверхности, все вышеперечисленное необходимо расположить поблизости. Термостат должен находиться рядом с сосудом Дьюара. Нужная температура в термостате или водяной бане составляет от +36 до +37°С. Необходимо открыть крышку сосуда Дьюара и найти нужную соломинку. Найти необходимую пайетку. Канистру с семенем важно держать ниже горлышка сосуда Дьюара, что предотвратит частичное размораживание других находящихся в канистре пайеток. При поиске нужной пайетки , канистру поднимают максимум на 5 секунд. Если попытку требуется повторить, то нужен перерыв, опустить канистру на место на 15 секунд. Пайетку достают не больше 3 за один раз из сосуда Дьюара специальным пинцетом, предварительно погрузив пинцет в жидкий азот для охлаждения. Важно сделать операцию очень быстро и сразу опустить пайетку в термостат. Продержать семя в термостате с температурой от +36 до +37°С в течение 1 минуты, контролируя время с помощью таймера. Далее достать соломинку из термостата, тщательно вытереть ее чистой сухой салфеткой, так как вода опасна для семени. Необходимо поместить соломинку с размороженной спермой в предварительно нагретый до температуры от +36 до +37°С шприц для искусственного осеменения. Для нагревания шприца используют термо-пенал, либо теплый раствор. Затем надеть на шприц защитный чехол. В период между разморозкой спермы и осеменением нельзя допускать резких температурных перепадов во внешней среде, поэтому заправленный шпиц вплоть до момента использования держат в термо-пенале. С момента оттаивания температура семени в соломинке должна оставаться на том же уровне или повышаться. Осеменение проводится в сжатые сроки. Максимальное время до осеменения для размороженной обычной спермы составляет 5-10 минут[7]. После проведения всех процедур, все использованные приборы обрабатываются и стерилизуются. Одноразовые - утилизируются. 8.Организация пункта искусственного осеменения животных на молочных фермах Пункт искусственного осеменения - основное место, где проводят работу по воспроизводству стада и обслуживанию коров. Их строят по типовым и индивидуальным проектам. Допускается организация пунктов в переоборудованных помещениях, отвечающих ветеринарно-санитарным и зоотехническим требованиям. При осеменении коров на пастбищах для каждого стада необходимо иметь передвижной пункт. Для осеменения телок на комплексах строят пункты, примыкающие к цеху содержания животных. 14-18-месячного возраста с расколами и прогонами для перевода скота в манеж. При проектировании, привязке, строительстве и организации пунктов искусственного осеменения на молочных фермах все предприятия независимо от их ведомственной подчиненности должны выполнять следующие основные технологические требования: пункт искусственного осеменения располагают непосредственно у помещений, в которых содержат животных, подлежащих осеменению, а также у естественных путей прогона скота (на прогулку, пастбище, доение и т.п.); пункт для осеменения коров и телок, принадлежащих населению, строят отдельно от места размещения общественного скота; пункт искусственного осеменения должен иметь манеж, лабораторию, моечную, кладовую, помещение для передержки коров и телок до и после осеменения. В манеже площадью не менее 16 м2 для лучшего освещения во время осеменения необходимо со стороны задней части туловища коров иметь окно размером не менее 1 м2 (на высоте 1 м от пола) или дополнительное электроосвещение. Панели стен до высоты 1,5 м от пола окрашивают масляными красками или выкладывают плиткой светлых тонов. При входе в манеж устанавливают дезбарьер. Пол должен быть с твердым покрытием, поддающимся чистке и мойке (с резиновыми дорожками) и уклоном 1-2°. В манеже устанавливают холодное и горячее водоснабжение, фиксационный станок. Под лабораторию отводят отапливаемую светлую комнату площадью не менее 6 м2, в которой размещают оборудование, приборы и инструменты для хранения и контроля качества спермы. Пол в лаборатории покрывают линолеумом или плиткой. Устанавливают бактерицидные лампы из расчета 1 Вт на 1 м3, стены облицовывают плиткой или красят белой масляной краской. Моечную не менее 6 м2, имеющую выход в манеж, располагают рядом с лабораторией [10]. 9.Методы обеззараживания посуды, инструментов и других материалов, используемых при искусственном осеменении животных и птиц Употребляемое для искусственного осеменения оборудование должно быть чистым и стерильным. Для этого новые или бывшие в употреблении инструменты и посуду подвергают тщательной обработке: моют в горячем растворе пищевой (20-30 г на литр воды) или стиральной соды (10-15 г на литр воды), отмывают щеткой, ершом или марлей, навернутой на корнцанг, резиновой трубкой или куском поролона; после мытья инструменты и посуду тщательно прополаскивают горячей водой, а затем дистиллированной, протирают чистым полотенцем или марлевой салфеткой, либо просушивают на воздухе, после чего стерилизуют и кладут на хранение. Стерилизация кипячением. Этим способом стерилизуют стеклянную посуду, шприцы-катетеры, металлические инструменты. Воду берут дистиллированную или кипяченую, остуженную и профильтрованную. Шприц катетер перед кипячением разбирают, цилиндр шприца обвертывают бинтом и прикрепляют к нему поршень (поршни индивидуально притерты к каждому цилиндру и менять их нельзя). Склянки обертывают марлей или ватой. На дно стерилизатора кладут слой марли или ваты, помещают инструменты отдельно от посуды, наливают воды 2/3 объема и кипятят 15-20 мин. Охлаждают, не снимая крышки. Стерильным пинцетом извлекают инструменты, в шприцы вставляют поршни (тщательно удаляя воду), завертывают шприцы в салфетку или бумагу (проглаженную горячим утюгом). С посуды воду удаляют стерильными марлевыми салфетками, закрывают крышками. Пластмассовые инструменты кипятят 5 минут в 2% растворе бикарбоната натрия, обмывают дистиллированной водой, просушивают. Металлические инструменты кладут в кипящую воду (иначе они покроются ржавчиной) и кипятят 15-20 мин. Высушивают, протирают стерильными салфетками [10]. Стерилизация сухим жаром. Проводится в сушильном шкафу при температуре 160-180 С или в духовке плиты в течение 15-30 мин. Стерилизуют сухим жаром стеклянную посуду, шприцы-катетеры в разобранном виде, предварительно обернув их бумагой. Стерилизация фламбированием. Фламбирование стерилизуют перед самым употреблением чисто вымытые влагалищные зеркала, ножницы и пинцеты, пенициллиновые флаконы, стеклянные палочки и т.д. Проводят фламбирование над не коптящим пламенем (рис.6).  Рисунок 6. Фламбирование влагалищного зеркала Обеззараживание спиртом. Для обеззараживания шприц-катетеров применяют 70 спирт-ректификат, с последующим удалением его стерильным свежеприготовленным 2,9% раствором цитрата натрия. Шприц тщательно отмывают от спермы 2,9% раствором цитрата натрия, набирают не менее 3 раз 70 спирт-ректификат и удаляют его остатки промыванием стерильным свежеприготовленным 2,8-3,0% раствором лимоннокислого натрия 5-6 раз. Пинцеты, стеклянные палочки и термометры обеззараживают тампонами, пропитанными 96 спиртом. Вазелин стерилизуют на водяной бане в течение 30 мин. Объем вазелина не должен превышать 100-150 мл, вода в «бане» должна доходить до уровня вазелина в банке. Все обработанные инструменты хранят в застекленных, окрашенных белой краской шкафах[10]. 10.Методики приготовления растворов разной концентрации Приготовление 2,9 %-ного раствора натрия лимонно-кислого (натрия цитрата). На 100 мл прокипяченной и охлажденной до 800С дистиллированной воды берут 2,9 г натрия лимонно-кислого (натрия цитрата) трехзамещенного пятиводного химически чистого или чистого для анализа и разводят в колбе круговыми движениями до полного растворения. Стерилизируют раствор натрия цитрата в кипящей водяной бане на протяжении 5-10 мин или подогревают до 90-950С. Готовят раствор ежедневно. Часто станции искусственного осеменения готовят раствор цитрата натрия в ампулах или флаконах и отпускают хозяйствам вместе с замороженной спермой. Такой раствор стерилизуют автоклавированием в течении 30 мин при температуре 1080С и давлении 0,4 атм. Цитрат натрия имеет слабощелочную реакцию и буферные свойства, он не токсичен для спермиев, нейтрализует молочную кислоту, которая накапливается в спермиях. Поэтому 2,9 %-ный раствор натрия цитрата используется при оценке качества спермы, ее размораживании, споласкивании спермоприемников, промывании инструментов для введения спермы и др. Приготовление 1 %-ного раствора бикарбоната натрия. Раствор готовят из расчета 1 г химически чистого натрия гидрокарбоната (натрия бикарбоната или пищевой соды – NаНСО3) на 100 мл прокипяченной и охлажденной до 40-450С дистиллированной воды. При температуре воды выше 600 натрий бикарбонат распадается, переходит в Nа2НСО3 и становится токсичным для спермиев. Водопроводная вода не пригодна для работы со спермой. 1 %-ный раствор натрия бикарбоната используют при оценке качества спермы, для увлажнения влагалищного зеркала, полиэтиленовых перчаток, промывания спермоприемников, инструментов для введения спермы (рис.7). Готовят его ежедневно[10].  Рисунок 7. Приготовление 1 %-ного раствора бикарбоната натрия Приготовление 0,9 – 1 %-ного раствора натрия хлорида. Раствор готовят из расчета 1 г химически чистого натрия хлорида (не йодированной соли) – NаСL на 100 мл прокипяченной дистиллированной воды. Можно брать таблетки натрия хлорида по 0,9 г каждая. После растворения соли раствор ставят на огонь и доводят до кипения. Раствор натрия хлорида готовят ежедневно и используют, как исключение, при отсутствии натрия цитрата или бикарбоната натрия для увлажнения и промывания инструментов, посуды после стерилизации ее в кипяченной воде, удаляют остатки спирта из инструментов и спермоприемника, увлажняют влагалищное зеркало. Известно, что ионы хлора негативно влияют на спермии. Растворы для обеззараживания Приготовление 70 %-ного спирта. 70 %-ный этиловый спирт готовят из 950-ного или 960 этилового спирта-ректификата. Известно, что 70 %-ный спирт менее коагулирует белки и поэтому глубже проникает в протоплазму микробов и этим влечет их гибель. Для приготовления 100 мл 70 %-ного спирта необходимо в стерильный цилиндр налить 73 мл 960 этилового спирта-ректификата и долить 27 мл прокипяченной дистиллированной воды до метки 100 мл и перемешать стерильной стеклянной палочкой. Расчет на приготовление 100 мл 70 %-ного спирта проводят по такой пропорции: 96 % ------ 100 мл 70 % ------ х мл где 70 х 100 х = --------------------- = 72,8 мл 96 Крепость спирта может проверяться с помощью спиртометра. Его протирают спиртовым тампоном и аккуратно опускают в узкий цилиндр со спиртом, где он должен свободно плавать, не касаясь дна. Если же крепость спирта будет выше, тогда доливают необходимо количество воды. 70 %-ный этиловый спирт готовят на 2-3 дня, хранят в банке с притертой пробкой и используют для обеззараживания инструментов для введения спермы, спермоприемников, баночек, инструментов и приборов, особенно при роботе в летних лагерях. После обеззараживания инструментов и приборов остатки спирта убирают промыванием физиологическим раствором 5-6 раз (рис.8).  Рисунок 8. Приготовление 70 %-ного спирта Приготовление 0,02 %-ного (1:5000) раствора и 0,01 %-ного раствора фуразолидона. Эти растворы готовят на 0,9-1 %-ном растворе натрия хлорида, дистиллированной или кипяченной воде из расчета 0,2 г фурацилина или 0,1 г фуразолидона на 1 л воды или раствора натрия хлорида. Указанные растворы используют для промывания и обмывания препуция у самцов, обмывания наружных половых органов самок перед осеменением, мытья искусственных вагин, а также рук перед и после осеменения животных. Растворы для мытья инструментов, посуды Приготовление 2-3 %-ного раствора натрия бикарбоната или 1- 1,5 %-ного раствора кальцинированной соды. Эти растворы готовят в чистой эмалированной посуде из расчета 2- 3 г натрия бикарбоната (двууглекислой соды, натрия гидрокарбоната, NаНСО3) или 1-1,5 г кальцинированной соды (натрий карбоната, двууглекислой соды, Nа2НСО3) на 100 мл горячей воды. Эти растворы используют для мытья искусственных вагин, влагалищных зеркал, посуды, инструментов, термосов, сосуда Дьюара, а также для обмывания кожи препуция у самцов и вульвы у самок перед осеменением. Вымытые в горячем растворе соды инструменты, посуда и другие предметы обязательно споласкивают чистой горячей водой 5-6 раз, вытирают чистой салфеткой и обеззараживают[10]. Заключение По завершению практики мною была достигнута главная цель учебной практики: освоение теоретических и практических знаний. Закрепив свои теоретические и практические знания, я лучше ознакомилась со своей профессией, а также данный опыт послужит хорошей ступенькой в моей дальнейшей карьерной лестнице. А также освоила темы такие как: Анатомо-топографические особенности полового аппарата самок, Ректальное исследование коров с целью определения физиологического состояния половых органов самок; Введение внутриматочных средств и тампонов во влагалище; Диагностика скрытого мастита у коров; Техника безопасности труда при работе с сосудом Дьюара; Технология оттаивания и подготовки семени к применению; Организация пункта искусственного осеменения животных на молочных фермах; Методы обеззараживания посуды, инструментов и других материалов, используемых при искусственном осеменении животных и птиц; Методики приготовления растворов разной концентрации, закрепив практическими занятиями. Список использованной литературы 1.Гончаров, В.П. Акушерство, гинекология и биотехника размножения животных: учебник / В. П. Гончаров, Д. А. Черепахин ; под редакцией В. В. Ракитская. — СПб.: Квадро, 2017. — 328 c. — ISBN 978-5-906371-76-3. — Текст: электронный // Электронно-библиотечная система IPR BOOKS: [сайт]. — URL: http://www.iprbookshop.ru/65601.html 2.Практикум по акушерству и гинекологии. [Электронный ресурс] : учеб. пособие / М.А. Багманов [и др.]. — Электрон. дан. — СПб. : Лань, 2017. — 308 с. 3.Уколов, П. И. Разведение и биотехника размножения сельскохозяйственных животных: учебник / П. И. Уколов, О. Г. Шараськина. — СПб.: Квадро, 2017. — 200 c. — ISBN 978-5-906371-84-3. — Текст: электронный // Электронно-библиотечная система IPR BOOKS: [сайт]. — URL: http://www.iprbookshop.ru/65608.html 4.Ветеринарное акушерство и гинекология/ А.П. Студенцов, В.С. Шипилов, Л.Г.Субботина; под ред. В.С. Шипилова.- 6-е изд., испр и доп.- М.: Агропромиздат, 2013.- 480с. 5.Козло Н.Е. Учебная книга техника по искусственному осеменению животных.- М.: Агропромиздат, 2010.- 56 с. 6.Небогатиков Г. В. Практикум по акушерству, гинекологии и биотехнике размножения животных. М.: Мир, 2014.-72 с. 7.Полянцев, Н.И. Акушерство, гинекология и биотехника размно-жения животных. [Электронный ресурс] : учеб. / Н.И. Полянцев, Л.Б. Михай-лова. — Электрон. дан. — СПб. : Лань, 2017. — 448 с. 8. Акушерство, гинекология. искуственное осеменение с/х животных.- /Под ред. Н. Михайлова.- М.: Агропромиздат, 2009.- 27 с. 9.Багманов, М.А. Практикум по акушерству и гинекологии: учебное пособие / М.А. Багманов, Н.Ю. Терентьева, С.Р. Юсупов и др. – СПб.: Издательство «Лань», 2017. - 308 с. 10.Терентьева, Н.Ю. Акушерство и биотехника размножения животных: учебное пособие для студентов среднего профессионального образования, обучающихся по специальности 36.02.01 Ветеринария / Н.Ю. Терентьева, В.А. Ермолаев. – Ульяновск: УГСХА, 2017. - 194 с. |
