Алпатова-ЛР №3-Диссоц. Конд.. Определение константы нестойкости тиоцианата (роданида) железа фотометрическим методом
 Скачать 65.07 Kb. Скачать 65.07 Kb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ Санкт-Петербургский горный университет  Кафедра общей и физической химии Отчет по лабораторной работе №3 По дисциплине: «Физическая химия» Тема: «Определение константы нестойкости тиоцианата (роданида) железа фотометрическим методом» Выполнили: студенты гр. НД – 18 – 2 _________ / Алпатова С.Е. / (подпись) (Ф.И.О.) Проверил: ассистент _________ /Пономарёва М.А./ (подпись) (Ф.И.О.) Дата: _________ Санкт-Петербург 2020 Цель работы: Определить константы нестойкости и энергии Гиббса образования роданидного комплекса железа (III). Краткие теоретические сведения: Согласно постулатам Бора системы существует лишь в особых стационарных состояниях, причем при переходе из одного в другое ими излучается энергия в виде кванта, выражаемая по формуле: 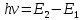 где:  постоянная Планка; постоянная Планка;  частота света; частота света;  энергии соответствующих стационарных состояний. энергии соответствующих стационарных состояний.Проходя через вещество (в данном случае исследуемый раствор), часть энергии света поглощается его молекулами, что приводит к уменьшению интенсивности. Зависимость интенсивности света от числа поглощающих молекул при монохроматическом излучении описывается законом Бугера-Ламберта-Бера (в экспоненциальной и логарифмической формах соответственно): 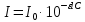 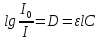 где: 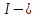 интенсивность прошедшего света; интенсивность прошедшего света;  интенсивность падающего света; интенсивность падающего света; 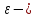 коэффициент поглощения; коэффициент поглощения;  толщина светопоглощающего слоя; толщина светопоглощающего слоя; 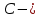 концентрация вещества в растворе; концентрация вещества в растворе;  оптическая плотность; оптическая плотность;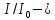 пропускание. пропускание.Закон Бугера-Ламберта-Бера справедлив только для газов и достаточно разбавленных растворов в инертных растворителях. С помощью фотометрического исследования окрашенных комплексов в растворах можно определить состав и константу нестойкости этих комплексов. Константой нестойкости называют константу равновесия диссоциации комплекса на составляющие его ионы или молекулы. Для ступенчатой реакции: 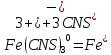 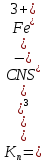 где:  общая константа нестойкости; общая константа нестойкости; 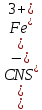 концентрации соответствующих ионов/молекул; концентрации соответствующих ионов/молекул;  ступенчатые константы нестойкости. ступенчатые константы нестойкости.при  можно считать, что можно считать, что  ; ;по з-ну Бугера-Ламберта-Бера  ; ;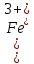 ; ;тогда, полная константа нестойкости равна:  Если привести уравнение к виду  и построить график в координатах и построить график в координатах 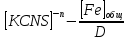 , по нему возможно определить , по нему возможно определить  и и  . .По значениям констант нестойкости определяют энергии Гиббса образования тиоцианатных комплексов железа (III) по n ступеням, пользуясь законом Гесса: 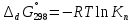 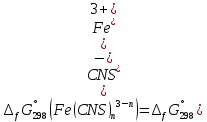 Ход эксперимента 1. Приготовить рабочий раствор соли железа. В маркированный химический стакан отобрать порцию стандартного раствора соли железа. Из химического стакана в мерную колбу объемом 200 мл мерной пипеткой отобрать 5 мл стандартного раствора соли железа, довести уровень жидкости в мерной колбе дистиллированной водой до метки, закрыть колбу пробкой и перемешать раствор, переворачивая мерную колбу не менее 40 раз. 2. В 7 мерных колб на 50 мл отбирают стандартный раствор железа от 2 до 8 мл с шагом в 1 мл, по 1 мл азотной кислоты и раствор роданида калия от 2 до 8 мл с шагом в 1 мл. 3. В отдельной мерной колбе объемом 50 мл приготовить раствор сравнения, содержащий 4 мл 1 М раствора роданида калия и 1 мл азотной кислоты. 4. Объем жидкости во всех колбах на 50 мл довести до метки дистиллированной водой. 5. Колбы закрыть пробками и хорошо перемешать. 6. При приготовлении раствора сравнения необходимо иметь в виду, что это раствор не должен быть окрашен. Присутствие окраски указывает на неверное приготовление раствора. 7. Измерить оптические плотности растворов в кюветах толщиной 1 см при длине волны 480 нм относительно раствора сравнения. Экспериментальные данные Концентрация стандартного раствора соли железа 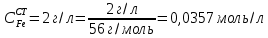 Объем стандартного раствора соли железа, взятый для приготовления 200мл рабочего раствора  Концентрация раствора роданида калия (аммония) 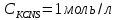 Толщина кюветы 1 см Длина волны 480 нм Таблица 1 Зависимость оптической плотности от количества роданида калия
Обработка экспериментальных данных 1. Определить концентрацию рабочего раствора соли железа: 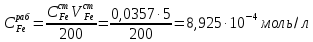 2. Вычислить содержание железа в колбах на 50 мл:  3. 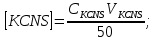
4. По данным таблицы построить три графика в координатах: 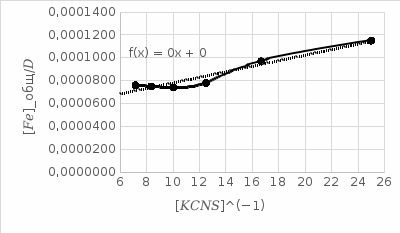 Рисунок 1. Зависимость   Рисунок 1. Зависимость 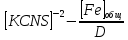 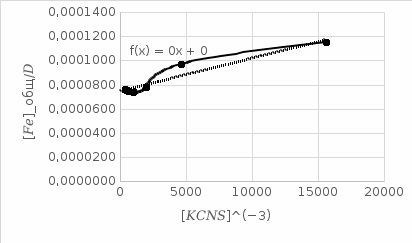 Рисунок 1. Зависимость 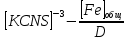 При помощи экстраполяции наиболее прямолинейной зависимости (в данном случае выбрана зависимость  ) до пересечения с осью ординат получаем значения ) до пересечения с осью ординат получаем значения  и и  . .Из графика:  ; ; 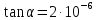 Тогда коэффициент поглощения 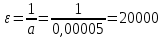 ; ; константа нестойкости 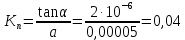 . .При  , , 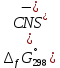 энергия Гиббса: 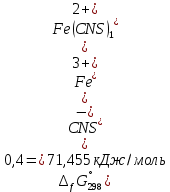 . .Вывод: В данной лабораторной работе мы вычислили константу нестойкости, равную 0,04 и энергии Гиббса образования роданидного комплекса железа (III), равная 71,455. Положительное значение энергии Гиббса свидетельствует о невозможности самопроизвольного протекания реакции образования роданида железа (III). |

 , моль/л
, моль/л