физика. Определение молярной массы эквивалента металла
 Скачать 158.9 Kb. Скачать 158.9 Kb.
|
|
МИНОБРНАУКИ РОССИИ Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина) Кафедра физической химии отчет по лабораторной работе №2 по дисциплине «Химия» Тема: Определение молярной массы эквивалента металла
Санкт-Петербург 2020 Цель работы: усвоение понятий эквивалента, молярной массы эквивалента, способов расчета молярных масс эквивалентов веществ; экспериментальное определение эквивалента неизвестного металла объемным методом. Основные теоретические положения Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Молярная масса эквивалента – это, масса одного моль эквивалента вещества, выраженная в граммах. Закон эквивалентов – вещества взаимодействуют между собой равным числом эквивалентов. Закон эквивалентов описывается выражением: 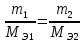 Где 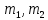 – массы взаимодействующих веществ, г; а – массы взаимодействующих веществ, г; а 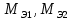 – молярные массы их эквивалентов, г/моль эквивалентов. – молярные массы их эквивалентов, г/моль эквивалентов.Схема установки: 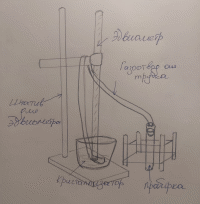 Протокол наблюдений Лабораторная работа № 2 «Определение молярной массы эквивалента металла» Вариант: 3 Температура опыта – 20 °С Атмосферное давление опыта – 767 мм рт. ст.
Обработка результатов 1. Приведите объем выделившегося водорода к нормальным условиям (н. у.): 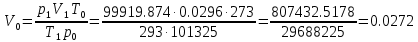 (л) (л)2. Рассчитайте молярную массу эквивалента металла, используя закон эквивалентов: 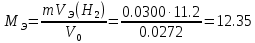 (г/моль) (г/моль)3. Определите молярную массу атомов металла Мат = zМЭ z=1: Мат1 =1‧12.35=12.35 (г/моль) z=2: Мат2 =2‧12.35=24.7 (г/моль) z=3: Мат3 =3‧12.35=37.05 (г/моль) Неизвестным металлом является Mg(24.305 г/моль). 4. Вычислите абсолютную и относительную погрешности определения молярной массы эквивалента металла: Абсолютная погрешность: 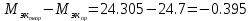 Относительная погрешность: 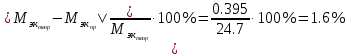 5. Приведите уравнение окислительно-восстановительной реакции: 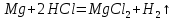 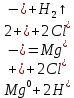 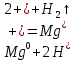 HCl является окислителем, Mg является восстановителем. Вывод: Экспериментальным путём, по реакции металла магния с соляной кислотой, была определена молярная масса эквивалента магния, равная 12,35 г/моль с абсолютной погрешностью -0,395 г /моль и относительной погрешностью 1,6%. Магний был выбран с помощью молярной массы металла и его валентности. Погрешности, в данном эксперименте, могли быть получены путем человеческого фактора или путем приборных погрешностей, допустим, таких как шкала измерений объема. |

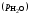 , Па
, Па Па
Па