Лабораторная ХИМИЯ. АДСОРБЦИЯ. Отчет по лабораторной работе 13 по дисциплине Физикохимические методы исследования материалов, реагентов и углеводородных систем
 Скачать 68.64 Kb. Скачать 68.64 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ»  Кафедра физической химии Отчет по лабораторной работе №13 по дисциплине «Физико-химические методы исследования материалов, реагентов и углеводородных систем» на тему «Анализ концентрации железа (III) в присутствии ионов никеля (II)» Выполнил: магистрант группы НТМ-18 /Мазуренко Н. А./ (должность) (подпись) (Ф.И.О.) магистрант группы НТМ-18 /Прохоров Д. А./ (должность) (подпись) (Ф.И.О.) Проверил: профессор /Литвинова Т.Е./ (должность) (подпись) (Ф.И.О.) доцент /Жадовский И.Т./ (должность) (подпись) (Ф.И.О.) Санкт- Петербург 2018 Цель работыПостроение кривых светопоглощения, выбор оптимального участка длин волн и определение в растворе концентрации соли железа в присутствии соли никеля. Краткие теоретические сведения Концентрацию определяемого вещества в анализируемом растворе при спектрофотометрических измерениях находят, как и в фотоэлектроколориметрии, с использованием либо основного закона светопоглощения, либо градуировочных графиков. Методы количественного анализа основаны на законе Бугера-Ламберта-Бера. Основными параметрами фотометрического определения являются длина волны, при которой производится измерение, оптическая плотность, толщина кюветы и концентрация окрашенного раствора. В соответствии с законом Бугера-Ламберта-Бера график в координатах оптическая плотность – концентрация должен быть линеен и прямая должна проходить через начало координат. Градуировочный график обычно строят не менее чем по трем точкам, что повышает точность и надежность определений. При отклонениях от закона Бугера-Ламберта-Бера, т.е. при нарушении линейной зависимости А от с, число точек на графике должно быть увеличено. Основные ограничения метода связаны с трудностями приготовления эталонных растворов и учетом влияния так называемых третьих компонентов, т. е. компонентов, которые находятся в пробе, сами не определяются, но на результат влияют. Сущность работыРастворы солей никеля и тиоцианатного комплекса железа имеют различную окраску, что позволяет выделить участок спектра, где светопоглощение комплексом железа велико, а светопоглощение раствором соли никеля незначительно. При этой длине волны оптическая плотность раствора будет почти целиком определяться концентрацией железа. Разность оптических плотностей раствора до прибавления роданида Dн и после его прибавления Dк (D = Dк – Dн ) пропорциональна концентрации железа. По известным значениям D для стандартных растворов строят калибровочный график в координатах D – концентрация железа (в мг/мл), а затем по величине D исследуемого раствора с помощью этого графика находят искомую концентрацию. Оборудование и реактивыСпектрофотометр или фотоколориметр; кюветы толщиной 1 см – 2 шт; колба мерная емкостью 200 мл – 1 шт.; колба мерная емкостью 100 мл – 2 шт.; колба мерная емкостью 50 мл – 8 шт.; стакан химический объемом 100 мл – 6 шт.; пипетка градуированная объемом 10 мл – 4 шт.; пипетка мерная объемом 5 мл – 1 шт.; стандартный раствор соли железа [(NH4)Fe(SO4)212H2O], содержащий 2 г/л железа (III); стандартный раствор соли никеля, содержащий 10 г/л никеля; тиоцианат (роданид) калия или аммония – 1 М раствор; соляная кислота – 2 н. раствор; пробы с исследуемым раствором. Выполнение работы1. Приготовить серию контрольных растворов. 1.1. В мерные колбы объемом 50 мл № 1 – 5 градуированной пипеткой объемом 10 мл отобрать 2 – 4 – 6 – 8 – 10 мл рабочего раствора соли железа. 1.2. В каждую колбу при помощи мерных пипеток добавить по 2 мл раствора азотной кислоты и по 5 мл раствора роданида калия (мерной пипеткой объемом 5 мл). 1.3. Во все колбы долить дистиллированную воду до меток на горлах колб. 1.4. Закрыть колбы пробками и перемешать, переворачивая колбы не менее 20 раз. 2. Выполнить измерение оптической плотности контрольных растворов. 2.1. Измерять оптическую плотность следует при длине волны 480 нм. 2.2. Начинать измерения оптической плотности контрольных растворов следует с самого разбавленного (наименее окрашенного). 2.3. В кювету толщиной 1 см налить до метки раствор сравнения и насухо протереть стенки кюветы салфеткой. 2.4. Кювету с раствором сравнения поместить в дальнее отделение кюветодержателя. 2.5. В другую кювету толщиной 1 см налить до метки окрашенный раствор, содержащий роданидный комплекс железа (III) и насухо протереть стенки кюветы салфеткой. 2.6. Кювету с окрашенным раствором поместить в ближнее отделение кюветодержателя. 2.7. Кюветодержатель поместить в кюветное отделение прибора. 2.8. Измерить оптическую плотность, следуя инструкции к пользованию прибором. 2.9. Результаты измерений занести в протокол лабораторной работы (табл. 7). 2.10. Достать кюветодержатель, повторить операции с 2.6 по 2.9 со всеми растворами. 2.11. Результаты измерений занести в протокол лабораторной работы (табл. 7). 3. Проведение анализа пробы, содержащей соль железа и никеля 3.1. В мерные колбы объемом 50 мл № 6 и 7 отобрать мерной пипеткой по 5 мл исследуемого раствора. 3.2. В каждую колбу добавить по 4 мл 2 н. раствора соляной кислоты 3.3. В мерную колбу № 6 прилить 4 мл раствора роданида калия. 3.4. Довести растворы до метки водой. 3.5. Измерить оптическую плотность приготовленных растворов при длине волны, установленной в первой части лабораторной работы по отношению к раствору сравнения железа (см. часть I). 3.6. Результаты эксперимента занести в таблицу № 8. Протокол лабораторной работы1. Концентрация стандартного раствора соли железа 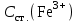 = 2 г/л. = 2 г/л.2. Объем стандартного раствора соли железа, использованный для приготовления рабочего раствора соли железа 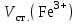 = 2 мл. = 2 мл.3. Объем приготовленного рабочего раствора соли железа Vраб. = 200 мл. 4. Объем пробы исследуемого раствора, взятый для анализа Va = 5 мл. 5. Аналитическая длина волны λ = 480 нм. 6. Толщина кюветы l = 1см. 7. № задачи 1. 8. Зависимость оптической плотности раствора от объема рабочего раствора соли железа
9. Результат измерения оптической плотности исследуемого раствора
Обработка результатов эксперимента 1. Вычислить концентрацию рабочего раствора соли железа по формуле 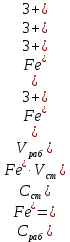 2. Рассчитать массу железа, содержащуюся в каждом из контрольных растворов по формуле: 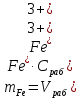 где  – объем рабочего раствора соли железа, взятый для получения контрольного раствора, мл, приведенный в табл. 9; – объем рабочего раствора соли железа, взятый для получения контрольного раствора, мл, приведенный в табл. 9; 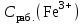 – концентрация рабочего раствора соли железа, вычисленная по формуле (16), мг/мл. – концентрация рабочего раствора соли железа, вычисленная по формуле (16), мг/мл.3.Заполнить таблицу 9 Таблица 9. Данные для построения градуировочной зависимости
4. По данным таблицы 9 построить градуировочную зависимость (рисунок 1) в координатах D – m(Fe)  Рисунок 1 – Градуировочный график 5. По данным таблицы 8 найти D = D(Fe) − D(Ni) = 0,698 – 0,009 = 0,689 6. Используя значение D по градуировочному графику определить массу железа в пробе.  =0,118 мг =0,118 мг7. Рассчитать концентрацию железа в пробе раствора по уравнению  где 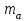 – масса железа, определенная по градуировочному графику, мг; – масса железа, определенная по градуировочному графику, мг; 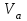 – объем пробы раствора, взятый для анализа, мл. – объем пробы раствора, взятый для анализа, мл.Вывод Таким образом, в данной лабораторной работе была выполнена заключительная часть фотометрического анализа. По полученным значениям был построен градуировочный график, который имеет прямолинейную форму. Графическим методом была определена масса железа в пробе с задачей. Затем была найдена концентрация железа. |
