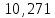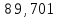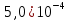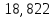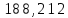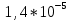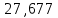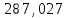Отчет по лабораторной работе 5 определение константы нестойкости тиоцианата (роданида) железа фотометрическим методом
 Скачать 148.55 Kb. Скачать 148.55 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО науки и высшего ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ Кафедра общей и физической химии ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ №5 ОПРЕДЕЛЕНИЕ КОНСТАНТЫ НЕСТОЙКОСТИ ТИОЦИАНАТА (РОДАНИДА) ЖЕЛЕЗА ФОТОМЕТРИЧЕСКИМ МЕТОДОМПо дисциплине Химия ч.2 (наименование учебной дисциплины согласно учебному плану) Выполнил: студент гр. НГС-21-2 Виноградов И.А. (шифр группы) (подпись) (Ф.И.О.) Оценка: Дата: Проверил руководитель работы: (должность) (подпись) (Ф.И.О.) Санкт-Петербург 2022 Цель работы: Определение константы нестойкости и энергии Гиббса образования тиоцианатного комплекса железа (III). Ход эксперимента: Был приготовлен рабочий раствор соли железа, путем отбора порции стандартного раствора соли железа и смешения его с дистиллированной водой в объемах, указанных в методическом указании к выполнению лабораторной работы. Затем в мерных колбах, вместимостью 50 мл, с №1 по №7 был приготовлен раствор для исследования, путем отбора и слива азотной кислоты, роданида калия, рабочего раствора соли железа и дистиллированной воды в необходимых объемах. В мерной колбе №8 был создан раствор из азотной кислоты, роданида калия и дистиллированной воды для получения раствора сравнения (эталонного). Полученные растворы были поочередно перелиты в кюветы, толщиной 1 см, и помещены в специальный прибор для измерения их оптической плотности, по отношению к раствору сравнения, при длине волны 480 нм. Экспериментальные данные Таблица 1. Исходные данные
Таблица 2. Зависимость оптической плотности от количества роданида калия
Обработка результатов эксперимента Таблица 3. Обработка результатов эксперимента
Пример расчетов искомых величин на основании полученных в ходе эксперимента данных (на основе содержимого колбы №1): 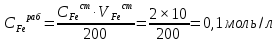 где 200 – объем приготавливаемого рабочего раствора соли железа, мл. 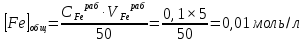 где 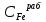 – концентрация рабочего раствора соли железа, моль/л; – концентрация рабочего раствора соли железа, моль/л; 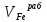 – объем рабочего раствора соли железа, взятый для приготовления растворов тиоцианата железа, мл; 50 – объем мерной колбы, мл. – объем рабочего раствора соли железа, взятый для приготовления растворов тиоцианата железа, мл; 50 – объем мерной колбы, мл. 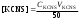 = = 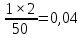 моль/л моль/лгде СKSCN = 1 моль/л; 50 – объем мерной колбы, мл; VKSCN – от 2 до 8 мл, с шагом 1 мл; 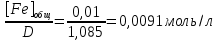 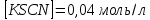 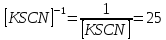 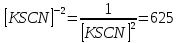 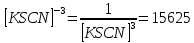 Графические зависимости: График 1. Графическая зависимость [Fe]общ/D = f([KCNS]-1) 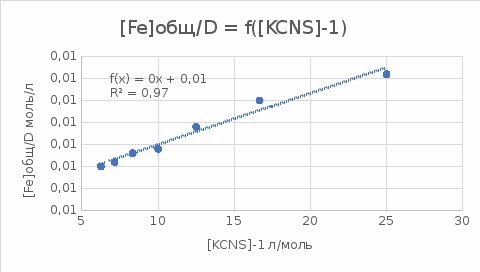 График 2. Графическая зависимость [Fe]общ/D = f([KCNS]-2) 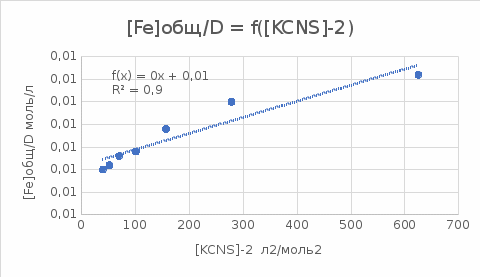 График 3. Графическая зависимость [Fe]общ/D = f([KCNS]-3) 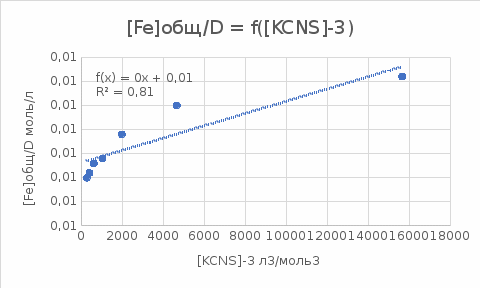 Анализ полученных результатов: а) [Fe]общ/D = f([KCNS]-1) Коэффициент 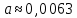 . .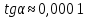 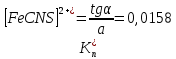 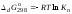 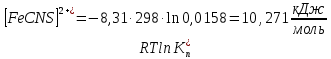 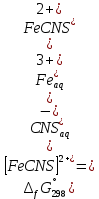 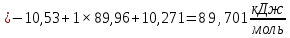 б) [Fe]общ/D = f([KCNS]-2) Коэффициент 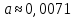 . .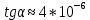 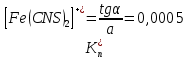 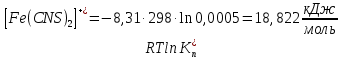  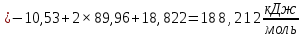 в) [Fe]общ/D = f([KCNS]-3) Коэффициент 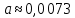 . .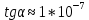 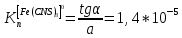 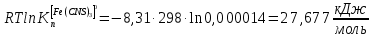 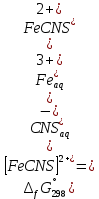 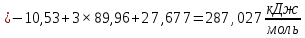 Таблица 4. Результаты вычислений
Сравнение полученных данных со справочными 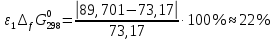 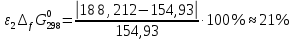 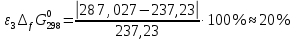 Вывод: В ходе лабораторной работы была определена константа нестойкости роданидного комплекса железа (III). Выяснено, что чем меньше константа нестойкости комплекса, тем нужно больше энергии для разрыва химических связей (она равна энергии Гиббса). Роданидный комплекс железа (III) является малоустойчивым, поэтому во избежание разрушения в раствор вводится избыток CNS--ионов. Для устойчивости красной окраски раствора вводился окислитель - раствор HNO3, для предотвращения обесцвечивания, вследствие восстановления железа (III) тиоцианат-ионами. В связи с невозможностью создать в растворе условия для образования одного комплекса, практически всегда приходится работать с раствором, содержащим одновременно целый ряд железороданидных комплексов, имеющих разные спектральные характеристики. Во избежание ошибок при определении железа роданидным методом всегда необходимо брать большой избыток реактива. |

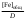 , моль/л
, моль/л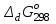 , кДж/моль
, кДж/моль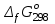 , кДж/моль
, кДж/моль