Отчет по лабораторной работе Гидролиз солей
 Скачать 32.97 Kb. Скачать 32.97 Kb.
|
|
Министерство образования и науки Российской Федерации Владимирский государственный университет Кафедра химии Отчет по лабораторной работе «Гидролиз солей» Работу выполнил: Студент группы С-211 Антропов А.С. Работу принял: Федоров Н.В. Владимир 2011г. Краткая теория к работе: При растворении многих солей в воде образующиеся при диссоциации ионы способны вступать во взаимодействие с молекулами воды. При этом происходит смещение равновесия при диссоциации воды, связывание ионов Н+ или ОH-, в результате чего изменяется рН раствора. В общем случае процесс обмена ионами между водой и растворёнными в ней солями называется гидролизом. Существует несколько видов гидролиза солей. 1. Гидролиз солей, образованных сильным основанием и слабой кислотой (например: CH3COONa, K2S03, Na2C03, Na2S). Гидролиз этих солей обусловлен связыванием ионов водорода в слабый электролит. Так, гидролиз ацетата натрия может быть представлен уравнениями: CH3COONa + H2O 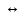 CH3COOH + NaOH CH3COOH + NaOHCH3COO- + Na+ H2O 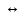 CH3COOH + Na+ + OH- CH3COOH + Na+ + OH-CH3COO- + H2O 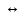 CH3COOH + OH- CH3COOH + OH- (pH > 7). Соли, образованные слабой многоосновной кислотой, гидролизуются ступенчато. Гидролиз протекает в значительно большей мере по первой ступени. Это приводит к образованию кислых солей. Na2S + H2O 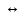 NaHS + NaOH NaHS + NaOH2Na+ S2- + H2O  Na+ + HS- + Na+ + OH- Na+ + HS- + Na+ + OH-S2- + H2O  HS- + OH- HS- + OH- (pH > 7). Растворы солей, образованных сильным основанием и слабой кислотой, имеют щелочную реакцию среды. 2. Гидролиз солей, образованных слабым основанием и сильной кислотой (например: NH4C1, CuSO4, Zn(NO3)2, A1C13). Гидролиз этих солей обусловлен связыванием гидроксид-ионов в слабый электролит. Так, гидролиз хлорида аммония может быть представлен уравнениями: NH4Cl + H2O  NH4OH + HCl NH4OH + HCl + Cl- + H2O + Cl- + H2O  NH4OH + H+ + Cl- NH4OH + H+ + Cl- + H2O + H2O 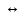 NH4OH + H+ NH4OH + H+ (pH < 7). Соли, образованные слабым многокислотным основанием, гидролизуются ступенчато. Процесс гидролиза протекает в большей мере по первой ступени, что приводит к образованию основных солей: Zn(NO3)2 + H2O 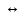 Zn(OH)NO3 + HNO3 Zn(OH)NO3 + HNO3Zn2+ +  + H2O + H2O 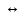 Zn(OH)+ + Zn(OH)+ + 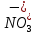 + H+ + + H+ + 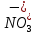 Zn2+ + H2O 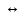 Zn(OH)+ + H+ Zn(OH)+ + H+ (pH < 7). Растворы солей, образованных слабым основанием и сильной кислотой, имеют кислую реакцию среды. 3. Гидролиз солей, образованных слабым основанием и слабой кислотой. Соли этого типа гидролизуются наиболее сильно, так как их ионы одновременно связывают ионы водорода и гидроксид-ионы воды. Например, гидролиз ацетата аммония может быть выражен уравнением: CH3COONH4 + H2O 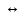 CH3COOH + NH4OH. CH3COOH + NH4OH.Соли, образованные слабыми многокислотными основаниями и слабыми многоосновными кислотами, гидролизуются необратимо: A12S3 + 6Н20 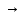 2Аl(ОН)3 2Аl(ОН)3 + 3H2S + 3H2S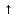 , ,поэтому не могут быть получены водные растворы таких солей, как Al(CO3)3, Cr2S3, Fe2S3 и др. В зависимости от соотношения констант диссоциации образующихся при гидролизе кислоты и основания растворы солей этого типа могут иметь слабокислую или слабощелочную среду реакции, т.е. pH 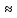 7. 7.4. Соли, образованные сильным основанием и сильной кислотой (например: NaCl, K2SO4, KNO3 и др.), гидролизу не подвергаются, так как при их растворении взаимодействия ионов этих солей с водой не происходит. Поэтому в растворах этих солей рН = 7, т. е. реакция среды остаётся нейтральной. Экспериментальная часть: Приборы и реактивы: спиртовка; микрошпатель. Растворы: карбоната натрия 0,2 н.; хлорида цинка 0,1 н.; нитрата натрия 0,2 н.; гидрокарбоната натрия 0,2 н; сульфата алюминия 0,1 н.; сульфата меди (II) 0,2 н.; соляной кислоты (концентрированная). Ацетат натрия кристаллический; вода дистиллированная; фенолфталеин; лакмус. Выполнение работы: Опыт 1: Изучение различных видов гидролиза 2-ая пробирка: 1.Na2CO3 + H2O  NaOH + NaHCO3 NaOH + NaHCO32Na+ +  + H2O + H2O  Na+OH- + Na+ + Na+OH- + Na+ + 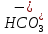  + H2O + H2O  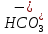 + OH- + OH-2. NaHCO3 + H2O  NaOH + H2CO3 NaOH + H2CO3Na+ + 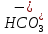 + H2O + H2O  Na+ + OH- + Na+ + OH- +  HCO3 + H2O  OH- + H2CO3 OH- + H2CO33-яя пробирка: 1.ZnCl2 + H2O  HCl + ZnOHCl HCl + ZnOHClZn2+ + 2Cl- + H2O  H+ + Cl- + ZnOH+ + Cl- H+ + Cl- + ZnOH+ + Cl-Zn2+ + Cl- + HOH  ZnOH+ + H+ ZnOH+ + H+2.ZnOH + H2O  HCl + Zn(OH)2 HCl + Zn(OH)2ZnOH+ + Cl- + H2O  H+ + Cl- + Zn(OH)2 H+ + Cl- + Zn(OH)2ZnOH+ + HOH-  H+ + Zn(OH)2 H+ + Zn(OH)2pH < 7 т.к. кислая среда. 4-ая пробирка: NaNO3 + H2O  NaOH + HNO3 NaOH + HNO3Na+ + 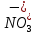 + H2O + H2O  Na+ + OH- + HNO3 Na+ + OH- + HNO3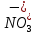 + H2O + H2O  HNO3 + OH- HNO3 + OH-
Опыт 2: Сравнение гидролиза кислых и средних солей 1-ая пробирка: Na2CO3 + H2O  NaOH + NaHCO3 NaOH + NaHCO32Na+ +  + H2O + H2O  Na+ + OH- + H+ + Na+ + OH- + H+ +  2-ая пробирка: NaHCO3 + H2O  H2CO3 + NaOH H2CO3 + NaOHNa+ + H+ +  + H2O + H2O  2H+ + 2H+ +  + Na+ + OH- + Na+ + OH-В ходе опыта, удостоверились в получение окраски веществ:
Выводом следует возможность образования кислых солей при гидролизе, т.к. соли, образуются путем слабой многоосновной кислотой и гидролизируются ступенчато, но гидролиз протекает в значительной мере по первой ступени, что и приводит к образованию кислых солей. Опыт 3: Получение и гидролиз соли слабого основания и слабой кислоты 1-ая пробирка: Al2(SO4)3 + 6H2O  2Al(OH)3 + 3H2SO4 2Al(OH)3 + 3H2SO42Al3+ + 3(SO4)2- + 6H2O  2Al3+ + 3OH- + 6H+ + 2Al3+ + 3OH- + 6H+ + 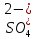 2-ая пробирка: Na2CO3 + H2O  NaOH + NaHCO3 NaOH + NaHCO32Na+ +  + H2O + H2O  Na+ + OH- + H+ + Na+ + OH- + H+ +  В ходе опыта, в пробирке наблюдается осадок алюминия, после добавления кислоты – вещество обесцыечивается. Полный и необратимый гидролиз солей. Некоторые соли, образованные слабыми летучими кислотами и многокислотными гидроксидами не могут находиться в виде водных растворов из-за полного необратимого взаимодействия с водой, сопровождающегося одновременным выделением газа и выпадением осадка. |
