Адсорбция на активированном угле. Отчет по лабораторной работе По дисциплине Термодинамика и кинетика
 Скачать 196.49 Kb. Скачать 196.49 Kb.
|
|
ПЕРВОЕ ВЫСШЕЕ ТЕХНИЧЕСКОЕ УЧЕБНОЕ ЗАВЕДЕНИЕ РОССИИ  МИНИСТЕРСТВО НАУКИ ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ» Кафедра общей и физической химии Отчет по лабораторной работе По дисциплине Термодинамика и кинетика (наименование учебной дисциплины согласно учебному плану) Тема работы: Молекулярная адсорбция на активированном угле Выполнил: студент гр. ГНГ-21-1 Филимонова А.А. (шифр группы) (подпись) (Ф.И.О.) Дата: Проверил: (должность) (подпись) (Ф.И.О) Санкт-Петербург 2023 г. Цель работы Рассчитать значение концентрации раствора кислоты, взятой на проведение адсорбции, вычислить значения удельной адсорбции растворенного вещества. Ход эксперимента Отобрали в химический стакан объемом 150 мл порцию муравьиной кислоты. Приготовили 4 раствора путем последовательного разведения (дистиллированной водой) в 2 раза В каждую колбу с приготовленными растворами высыпали по навеске 3 г активированного угля. Колбы поставили на перемешивающее устройство на 15 минут. Осторожно слили растворы через бумажный фильтр в конические колбы Чтобы определить концентрацию кислоты в исходном С0 и равновесных С* растворах, в 2 конические колбы мерной пипеткой отобрали по 5 мл пробы, затем в каждую колбу добавить немного дистиллированной воды. Затем в каждую колбу прилили по 3-4 капель индикатора – фенолфталеина и, залив в бюретку щёлочь (NaOH), титровали колбы с растворами, постоянно помешивая, до перехода окраски фенолфталеина от бесцветной к малиновой. Полученное значение объема щелочи занесли в таблицу 2 протокола лабораторной работы. Довели объем щелочи в бюретке до отметки «0» и провели повторное титрование пробы во второй конической колбе. Полученное значение объема щелочи занесли в таблицу 2 протокола лабораторной работы. Экспериментальные данные Таблица 1 – Содержание протокола лабораторной работы
Таблица 2 – Результаты анализа проб кислоты
Обработка результатов эксперимента Концентрация раствора кислоты, взятого на приготовление растворов и проведение адсорбции: 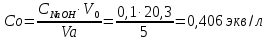 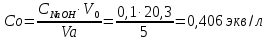 где V0 – средний объем гидроксида натрия, затраченный на титрование пробы исходной кислоты, мл. Равновесные концентраций кислоты: 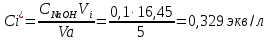 где Vi – средний объем гидроксида натрия, затраченный на титрование пробы кислоты после адсорбции, мл. Изменение концентрации кислоты в процессе адсорбции: 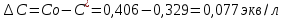 Удельная адсорбция растворенного вещества Г: 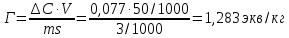 где V – объем кислоты, взятый на адсорбцию, л; ms – навеска адсорбента (активированного угля), кг. Таблица 3 - Данные для построения изотерм адсорбции
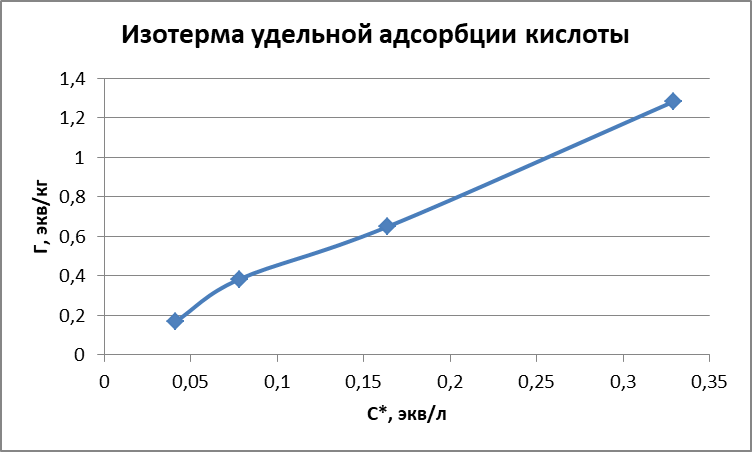 Рисунок 1 - Изотерма удельной адсорбции 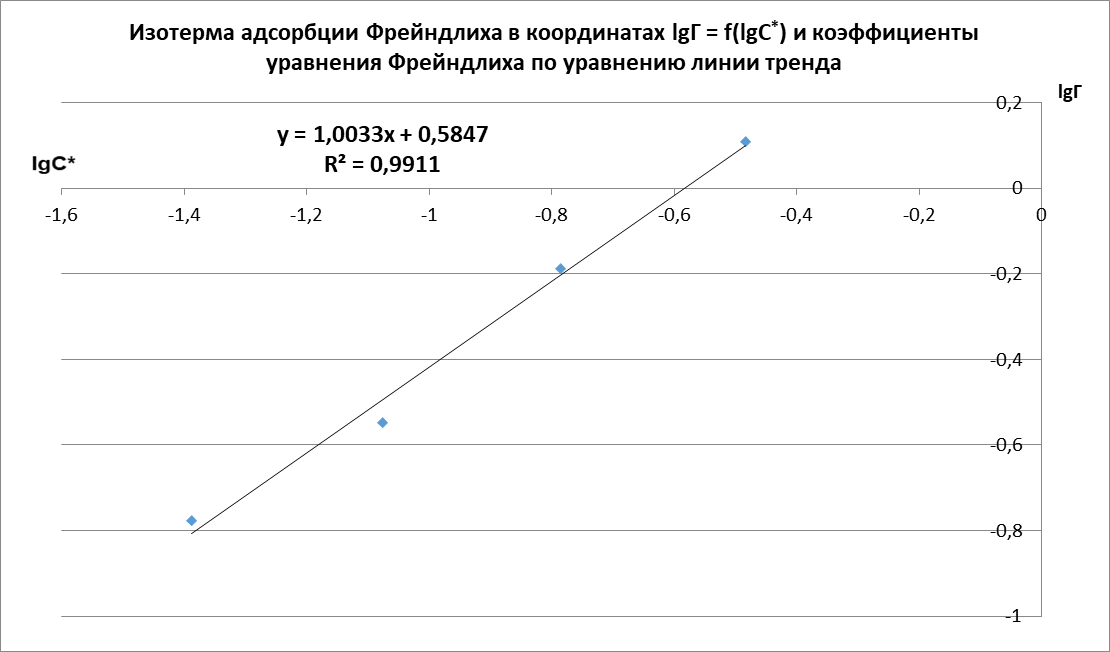 Рисунок 2 – Линейная форма уравнения адсорбции Фрейндлиха lgK = 0,5847 1/n = 1,0033 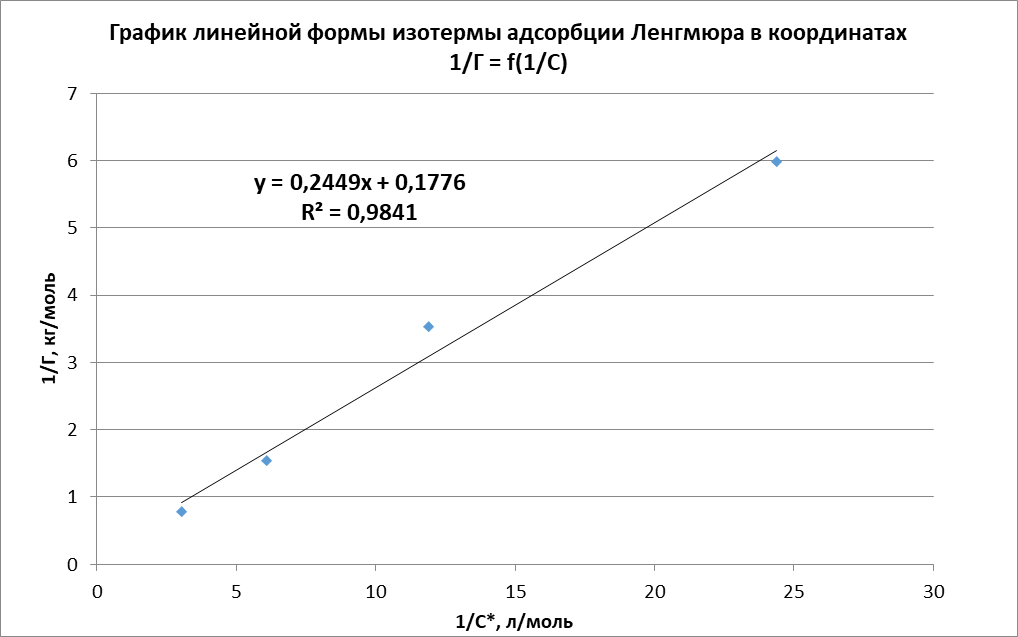 Рисунок 3 - Линейная форма уравнения адсорбции Ленгмюра в координатах 1/Г = f(1/C) 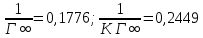 Константа уравнения Ленгмюра Г∞: 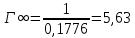 Удельная поверхность активированного угля: Sо=Г∞ 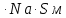 = = 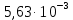 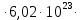 20,51020 = 695 м2/г 20,51020 = 695 м2/ггде NA – число Авогадро; SM – площадь поперечного сечения молекулы адсорбата, равная для карбоновых кислот 20,51020 м2. Вывод В ходе лабораторной работы была определена концентрация раствора кислоты, взятой на проведение адсорбции, она составила 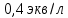 . Концетрация опредена правильно, так как теоретические значение концентрации муравьиной кислоты 0,4 экв/л. . Концетрация опредена правильно, так как теоретические значение концентрации муравьиной кислоты 0,4 экв/л. Также были построены изотермы адсорбции, проверена применимость к ним уравнений Фрейндлиха и Ленгмюра, определены постоянные, входящие в них ( 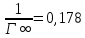 ; ;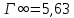 ) и удельная поверхность активированного угля Sо= 695 м2/г, что входит в теоретические рамки удельной поверхности активированного угля (от 300 до 1000 м2/г). ) и удельная поверхность активированного угля Sо= 695 м2/г, что входит в теоретические рамки удельной поверхности активированного угля (от 300 до 1000 м2/г). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
