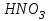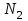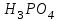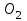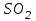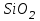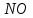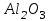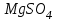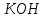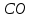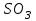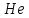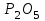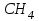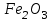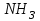Практическая работа химия 1 курс. Практическая работа №1 готово. Практическая работа 1 Основные численные характеристики вещества. Расчеты по химическим формулам и уравнениям
 Скачать 205.63 Kb. Скачать 205.63 Kb.
|
|
ПРАКТИЧЕСКАЯ РАБОТА №1 Основные численные характеристики вещества. Расчеты по химическим формулам и уравнениям. Цель работы: закрепление знаний по основным химическим понятиям и законам. Оборудование: Периодическая система химических элементов Д.И.Менделеева. Измерения в химии производятся с использованием принятой во всем мире, в том числе и в России, Международной системы единиц измерения (СИ). В этой системе имеется семь основных единиц: метр (м, длина), килограмм (кг, масса), секунда (с, время), ампер (А, сила тока), Кельвин (К, температура), кандела (кд, сила света), и моль (количество вещества) Атом – наименьшая частица химического элемента, являющаяся носителем его свойств и неделимая при химических реакциях. Молекула– наименьшая частица простого или сложного вещества, определяющая его свойства, способная к самостоятельному существованию; состоит из атомов одного (простое вещество) или различных (сложное вещество) химических элементов (С, Si, P4, S8, O2, O3, F2, N2, Fe, Cu – простые вещества; Н2О, СО2, СаСО3, Са3(РО4)2 – сложные вещества). Химический элемент – совокупность атомов естественного изотопического состава этого элемента с одинаковым зарядом ядра. Относительные атомные и молекулярные массы (Аr, Мr). Установление стехиометрических законов позволило приписать атомам химических элементов строго определенную массу. Массы атомов чрезвычайно малы. Так, масса атома водорода составляет 1,67·10−27 кг, кислорода − 26,60·10−27 кг, углерода − 19,93·10−27 кг. Пользоваться такими числами при различных расчетах очень неудобно. Поэтому с 1961 г. за единицу массы атомов принята 1/12 массы изотопа углерода 12С − углеродная единица (у. е.) или атомная единица массы (а. е. м.). Масса у. е. составляет 1,66043 . 10−27 кг (1,66043 . 10−24г). Относительной атомной массой элемента (Аr) называют отношение абсолютной массы атома к 1/12 части абсолютной массы атома изотопа углерода 12С. Аr показывает, во сколько раз масса атома данного элемента тяжелее 1/12 массы атома 12С. Например, Аr кислорода равна
Это означает, что атом кислорода примерно в 16 раз тяжелее 1/12 массы атома углерода 12С. Относительные атомные массы элементов (Аr) обычно приводятся в периодической таблице Менделеева. Относительной молекулярной массой (Мr) вещества называется масса его молекулы, выраженная в у. е. Мr численно равна сумме атомных масс всех атомов, входящих в состав молекулы вещества. Она подсчитывается по формуле вещества. Например, относительная молекулярная масса серной кислоты H2SO4 будет слагаться из:
Значит, Мr (H2SO4) равна 98,16, или округленно 98. Это означает, что масса молекулы серной кислоты в 98 раз больше 1/12 массы атома изотопа 12С. Относительные атомные и молекулярные массы − величины относительные, а потому − безразмерные. Кроме рассмотренных величин, в химии чрезвычайное значение имеет особая величина − количество вещества. Количество вещества определяется числом структурных единиц (атомов, молекул, ионов или др.)этого вещества и выражается в молях. Моль − это количество вещества, содержащее столько структурных или формульных единиц, сколько атомов содержится в 12 г (0,012 кг) изотопа 12С. Понятие «моль» распространяется на любые структурные единицы (это могут быть реально существующие частицы, такие, как атомы (К, О, С), молекулы (Н2, СО2), катионы (К+, Са2+), анионы (CO , ), радикалы (ON• , NO ),•2 формульные единицы (КОН, ВеSO4), электроны и др. Экспериментально установлено, что в 12 г изотопа 12С содержится 6,02⋅1023 атомов (постоянная Авогадро, NА); ее размерность − моль−1. При применении понятия «моль» надо указывать, какие структурные единицы имеются в виду. Например, 1 моль атомов Н содержит 6,02·1023 атомов Н, 1 моль молекул Н2О содержит 6,02·1023 молекул Н2О, 1 моль ионов Н+ содержит 6,02·1023 ионов Н+ и т. д. Количество вещества обозначается буквой n. Отношение массы вещества (m) к его количеству (n) представляет собой: Молярная масса вещества численно равна относительной молекулярной массе этого вещества (Мr), выраженной в атомных единицах массы. Так, молекула Н2О имеет массу (Мr) 18 а. е. м., а 1 моль Н2О (т. е. 6,02⋅1023 молекул) имеет массу 18 г. Многие вещества (например, кислород и водород) существуют в газообразном состоянии. Газы подчиняются определенным законам. Было экспериментально установлено, что все газы (при t = const) одинаково сжимаются (закон Бойля − Мариотта: PV = const или Р1V1 = P2V2), обладают одинаковым термическим коэффициентом расширения (законы Гей – Люссака и Шарля: VT=const при постоянном давлении,PT= const при постоянном объеме) и имеют некоторые другие общие свойства. Сочетание обоих законов находит свое выражение в уравнении Клапейрона 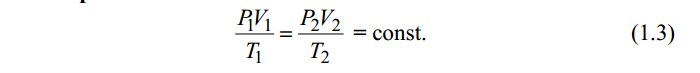 (Этим выражением пользуются для приведения объемов газов от одних условий температуры и давления к другим.) На основе этих газовых законов и своих наблюдений Авогадро сформулировал закон (1811 г.): в равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул. Если взять 1 моль любого газа, то легко убедиться взвешиванием или измерением объемов, что при нормальных условиях он займет объем 22,4 л. Это так называемый мольный объем газа. Нормальные условия в Международной системе единиц (СИ): давление 1,013⋅105 Па (760 мм рт. ст. = 1 атм.); температура 273 К (0 ºС). Если условия отличаются от нормальных, мольный объём имеет другое значение, для расчетов которого можно воспользоваться уравнением Менделеева− Клапейрона: 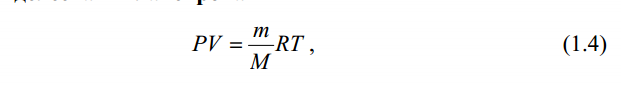 где Р − давление газа; V − объем; m − масса газа; М − молярная масса, Т − температура (К); R − универсальная (молярная) газовая постоянная, численное выражение которой зависит от единиц, определяющих объем газа и его давление. В Международной системе измерений (СИ) R = 8,314 Па⋅м3/ моль ⋅ К(Дж/моль·К). Для внесистемных единиц измерения давления и объема величина R имеет значения:
Эти законы сыграли большую роль в установлении атомно-молекулярного строения газов и в настоящее время широко используются для расчетов количеств реагирующих газов. Типовые задачи: Рассчитать массу атома кремния ?  - ? - ?Рассчитать  возможно пользуясь значением атомной массы кремния возможно пользуясь значением атомной массы кремния 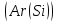 представленной в периодической системе химических элементов (ПСХЭ) Менделеева. представленной в периодической системе химических элементов (ПСХЭ) Менделеева. численно равна молярной массе атома элемента численно равна молярной массе атома элемента 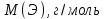 . . можно рассчитать двумя способами, пользуясь следующими основными понятиями химии: можно рассчитать двумя способами, пользуясь следующими основными понятиями химии:а) Атомная масса элемента  , , , ,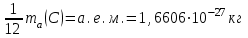 , , = =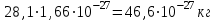 . .б) Абсолютная масса одной молекулы (атома) определяется делением молярной массы на число Авогадро 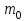 = =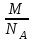 , отсюда М- молярная масса, NA- число Авогадро, следовательно , отсюда М- молярная масса, NA- число Авогадро, следовательноm0=28.1*10-3/6.02*1023=4.66*10-26=46.67*10-27кг. 2. Масса молекулы 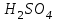 - серной кислоты ( - серной кислоты (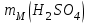 ) равна? ) равна?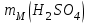 - ? - ?Учитывая, что в 1 моль вещества 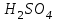 содержится содержится 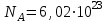 его молекул его молекул 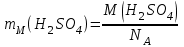 . .Молярная масса вещества ( 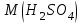 ) рассчитывается как сумма молярных масс атомов образующих вещество ) рассчитывается как сумма молярных масс атомов образующих вещество 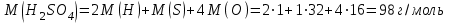  3. Молярная масса 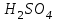 равна равна 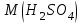 . .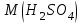 - ? - ?см. п. 2. 4. Число молекул  в 50 г. вещества – хлор () равно в 50 г. вещества – хлор () равно 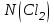 - ? Какой объем при н. у. будет занимать данная масса - V() – ? - ? Какой объем при н. у. будет занимать данная масса - V() – ?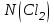 - ? - ?V() – ? 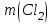 - ? - ?Некоторую порцию вещества можно численно оценить по массе (m), объему (V) (если вещество газообразное) и по количеству вещества ( 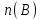 ). Между ними следующие соотношения: ). Между ними следующие соотношения: 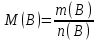 , , 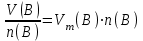 , , 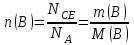 , ,для газообразных веществ 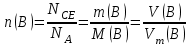 . .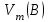 - молярный объем газа, т. е. объем 1 моль газа при нормальных условиях (н. у.) - - молярный объем газа, т. е. объем 1 моль газа при нормальных условиях (н. у.) - 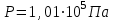 , , . . 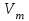 для любого газа 22,4 л. Отсюда, для любого газа 22,4 л. Отсюда, 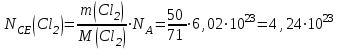 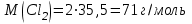 . .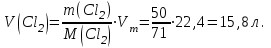 5. Плотность ( 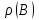 ) и относительная плотность по воздуху ( ) и относительная плотность по воздуху ( ) хлора ) хлора() при н. у. равны?  - ? - ?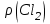 - ? - ?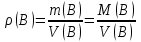 , ,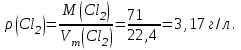 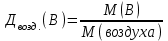 , , 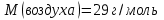 , , . .6. Молярная масса газообразного вещества ( 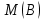 ) 250 мл., которого при н. у. имеет массу 0,770 г. равна? Назовите этот газ. ) 250 мл., которого при н. у. имеет массу 0,770 г. равна? Назовите этот газ.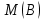 - ? - ? 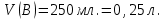 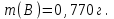 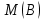 можно рассчитать двумя способами: можно рассчитать двумя способами:а)  , ,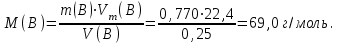 б) Пользуясь уравнением Менделеева –Клапейрона 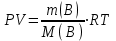 , , 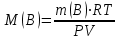 , ,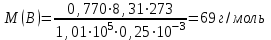 . .Рассчитайте молярные массы наиболее распространенных, известных Вам газов и сравните ее с полученной Вами при решении данной задачи. Можно предположить, что это 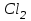 . .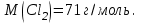 ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ 1. Масса атома химического элемента 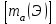 Э – (химический знак атома Э приведен в табл. 7.1, графа 1, соответственно № варианта) равна Э – (химический знак атома Э приведен в табл. 7.1, графа 1, соответственно № варианта) равна  2. Масса молекулы вещества 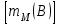 В – (химическая формула вещества приведена в табл. 7.1, графа 2, соответственно № варианта) равна В – (химическая формула вещества приведена в табл. 7.1, графа 2, соответственно № варианта) равна 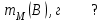 3. Молярная масса вещества, М(В), г/моль В – (химическая формула вещества приведена в табл. 7.1, графа 3, соответственно № варианта) равна 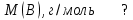 4. Число молекул 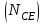 в 50г. вещества В – (химическая формула вещества приведена в табл. 7.1, графа 4, соответственно № варианта) равно в 50г. вещества В – (химическая формула вещества приведена в табл. 7.1, графа 4, соответственно № варианта) равно 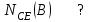 Какой объем при н.у. будет занимать данная масса вещества 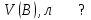 5. Плотность 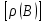 и относительная плотность по воздуху и относительная плотность по воздуху 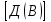 вещества В – (химическая формула вещества вещества В – (химическая формула вещества 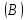 приведена в табл. 7.1, графа 5) при н.у. равны приведена в табл. 7.1, графа 5) при н.у. равны   6. Молярная масса газообразного вещества 250мл. которого при н.у. имеет массу 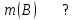 ( масса вещества приведена в табл. 7.1, графа 6, соответственно № варианта) равна ( масса вещества приведена в табл. 7.1, графа 6, соответственно № варианта) равна 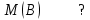 Назовите какой это газ? Назовите какой это газ?
Таблица 7.1. А)Атомная масса элемента  , ,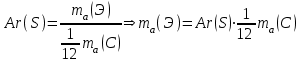 , ,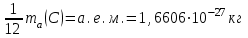 , ,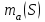 = =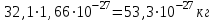 . .Б) Абсолютная масса одной молекулы (атома) m0=32.1*10-3/6.02*1023=4.66*10-26=53,32*10-27кг. 2. Масса молекулы вещества 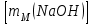 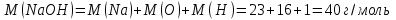 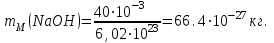 3. Молярная масса вещества, М(В), 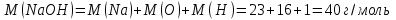 4. Число молекул 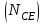 в 50г. вещества В в 50г. вещества В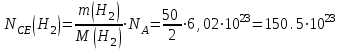 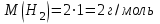 . .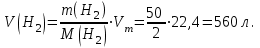 5. Плотность 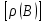 и относительная плотность по воздуху и относительная плотность по воздуху 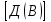 вещества вещества 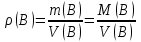 , ,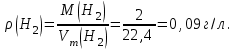 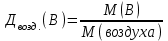 , , 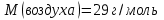 , ,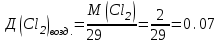 6. Молярная масса газообразного вещества 250мл. которого при н.у. имеет массу  а) 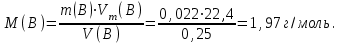 б) 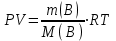 , , 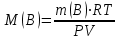 , ,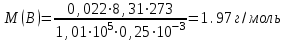 . .Газ-водород 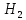 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

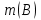 , г.
, г.