|
|
Практическая работа №6 тгив. Практическая работа 6 По дисциплине теория горения и взрыва концентрационные и температурные пределы распространения пламени
Министерство науки и высшего образования Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего образования
«Сибирский государственный университет геосистем и технологий»
(ФГБОУ ВО «СГУГиТ»)
Утверждено редакционно-издательским советом университета
в качестве практикума для обучающихся по направлению
подготовки 20.03.01 Техносферная безопасность (уровень бакалавриата)
Институт кадастра и природопользования
Кафедра Техносферной безопасности
Практическая работа № 6
По дисциплине: ТЕОРИЯ ГОРЕНИЯ И ВЗРЫВА
Концентрационные и температурные пределы распространения пламени
Вариант 6
Выполнил :
Студент (-ка): ____
Группы: _________
Проверил:
руководитель: _________
г. Новосибирск - 2022
Цель работы: закрепить навык определения концентрационных и температурных пределов возникновения и распространения пламени.
Задание
В соответствии со своим номером в списке обучаемых выбрать вещество из таблицы 2.2.1 и согласно порядку выполнения работ оценить: нижний и верхний концентрационные пределы, КПРП, температурные пределы воспламенения, класс жидкости по степени пожароопасности, расчет температуры и количества жидкости для проведения технического обслуживания приборконтроля концентрации взрывоопасных газов и паров.:
Индивидуальное вещество – циклобутан 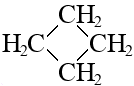
1. Оценить нижний и верхний концентрационные пределы распространения пламени в воздухе индивидуального горючего вещества, используя только химическое уравнение горения.
Решение:
Запишем уравнение реакции горения циклобутана:
C4H8 + 6(О2 + 3,76) → 4СО2 + 4Н2О + 6·3,76N2
При эквивалентном соотношении топлива и кислорода φ = 0,5 химическое уравнение горения циклобутана в воздухе будет выглядеть следующим образом:
0,5C4H8 + 6(О2 + 3,76N2) → 2СО2 + 2Н2О + 3О2 + 3·3,76N2
Количество воздуха избыточное, поэтому в продуктах сгорания есть кислород. Концентрация паров циклобутана в % в исходной смеси и есть искомое значение НКПР и находится из мольной или объемной доли циклобутана в исходной горючей смеси (левая часть уравнения) умноженной на 100%:
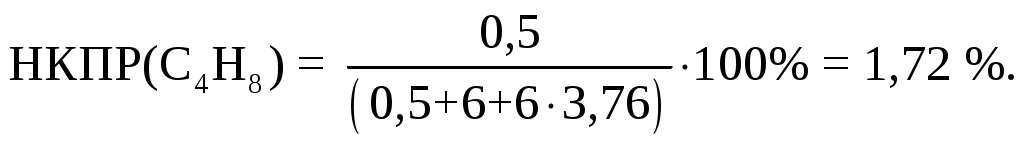
Экспериментально измеренное значение НКПР(С4Н8) = 1,84%.
Относительная ошибка составила: 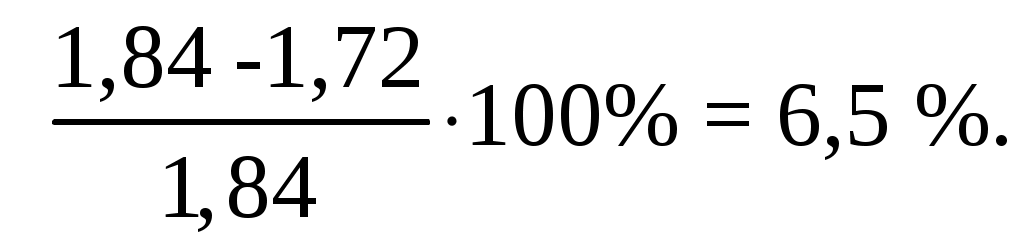
При определении ВКПР эквивалентным соотношением топлива и кислорода φ = 1,5 химическое уравнение горения циклобутана будет выглядеть следующим образом:
1,5C4H8 + 6(О2 + 3,76N2) → 4СО2 + 4Н2О + 0,5C4H8+ 6·3,76N2
Количество кислорода в воздухе не достаточно для полного окисления циклобутана, поэтому в продуктах сгорания имеется циклобутан. Концентрация паров циклобутана в исходной смеси и есть искомое значение ВКПР и находится из мольной или объемной доли циклобутана в исходной горючей смеси (левая часть уравнения) умноженной на 100%:
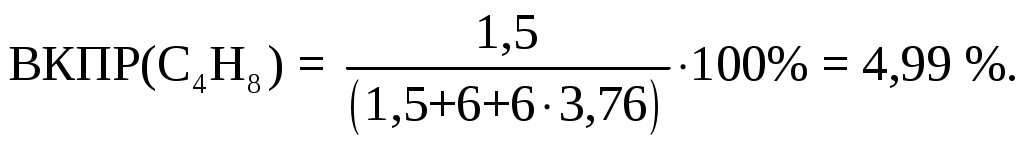
Ответ: НКПР(С4Н8) = 1,72%; ВКПР(С4Н8) = 4,99%.
2. Оценить КПРП в воздухе смеси циклобутана с метиловым спиртом CH3OH, если соотношение веществ составляет 1 к 4 по массе.
Решение:
Рассчитаем количество молей в 1 кг смеси. Если соотношение масс 1 к 4, то смесь состоит из 200 г циклобутана и 800 г метанола. Следовательно, состав смеси по массе:
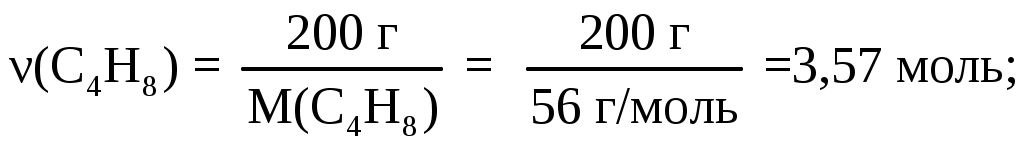
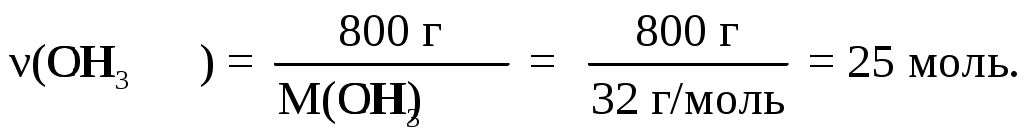
Состав в объемных процентах:
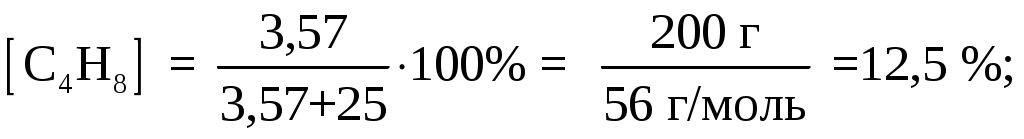
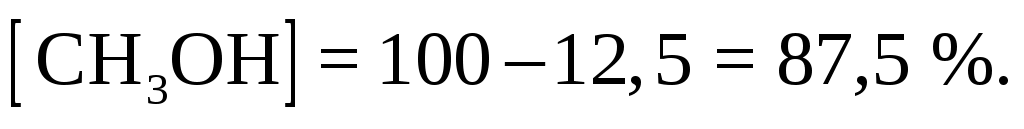
Оценить НКПР смеси разных веществ можно с помощью закона Ле-Шателье:
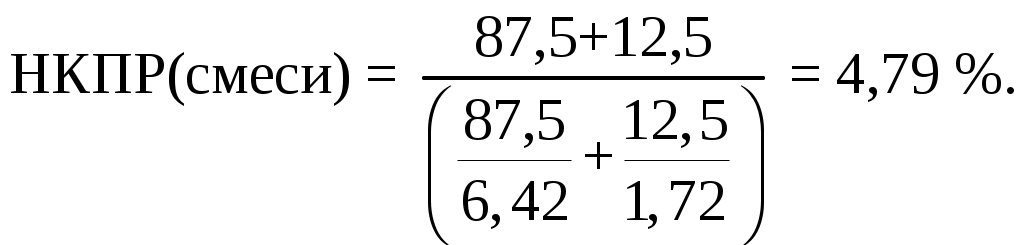
Ответ: НКПР смеси равно 4,79%.
3. Оценить НКПР смеси горючих паров/газов в воздухе из п.2 по ее теплоте горения. Сравнить с решением из предыдущего пункта.
Решение:
Состав смеси по объему:
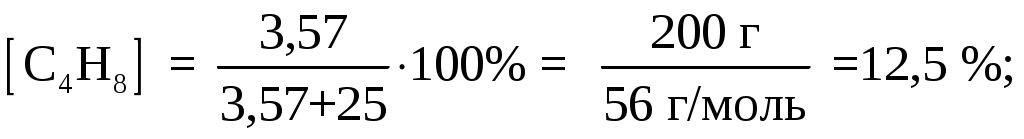
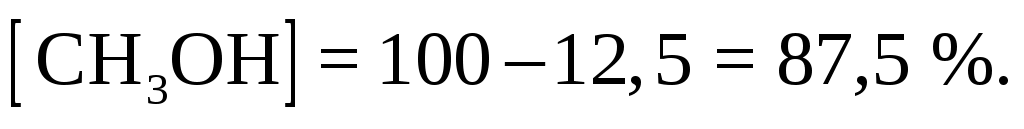
Количество молей в 1 м3:
Циклобутан: 125/22,4 = 5,58 моля;
Метанол: 875/22,4 = 39,06 моля.
Составляем химическое уравнение горения 1 кг смеси:
5,58C4H8 + 39,06 СН3ОН + z(О2 + 3,76N2) → xСО2 + yН2О+ z·3,76N2
Вычисляем коэффициенты x, y, z их закона сохранения атомов в любых химических реакциях. Вычисления производим последовательно слева направо для С и Н, а для О справа налево:
х = 5,58·4 + 39,6·1 = 61,92;

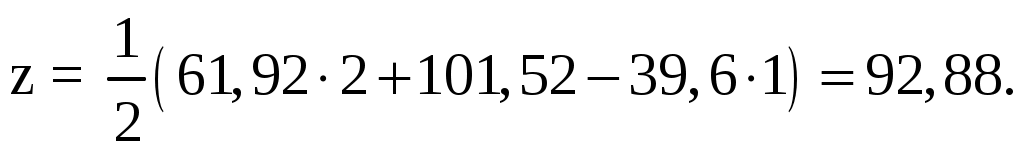
Подставляем коэффициенты и получаем необходимый нам вид химического уравнения горения 1 кг смеси:
5,58C4H8 + 39,06 СН3ОН + 92,88(О2 + 3,76N2) → 61,92СО2 + 101,52Н2О+ 92,88·3,76N2
Используя закон Гесса, вычисляем теплоту горения для 1 кг смеси:
Qгор.смеси = [5,58ΔН0(C4H8) + 39,06 ΔН0(СН3ОН)] - [61,92ΔН0(CО2) + 101,52 ΔН0(Н2О)];
Qгор.смеси = [5,58·26,65 + 39,06(-205)] - [61,92(-393,51) + 101,52(-241,83)] = 41058 кДж/м3 = 41,1 МДж/м3.
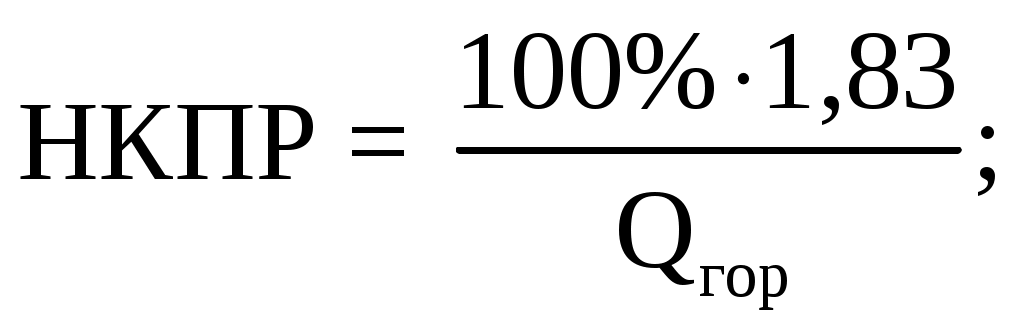
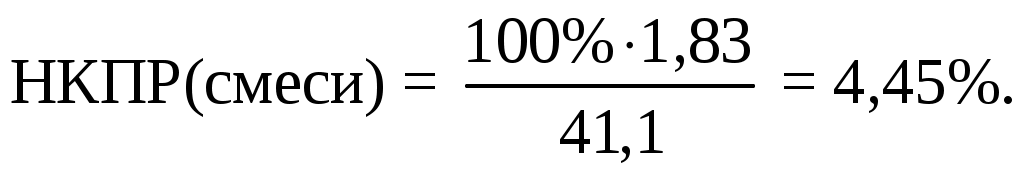
Исходя из решения предыдущего пункта, разница в оценках составила:

Ответ: НКПР смеси равно 4,45%.
4. Определить возможность образования взрывоопасной концентрации в помещении объемом 150 м3 при полном испарении 12 кг горючей жидкости из п.1, если температура в помещении 32 оС, а давление 745 мм.рт.ст.
Решение:
Молекулярная масса циклобутана 56 г/моль, в 12 кг количество молей:
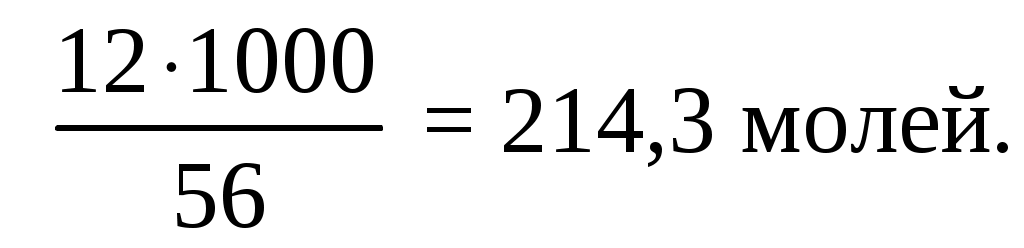
Молярный объем равен:
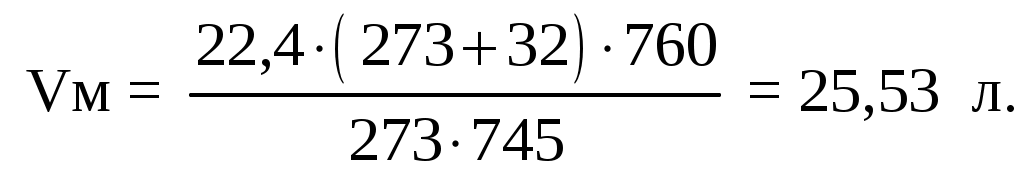
Объем 214,3 молей паров = 25,53·214,3 = 5471 л =5,5 м3.
Следовательно, концентрация паров циклобутана в помещении объемом 150 м3 будет равна
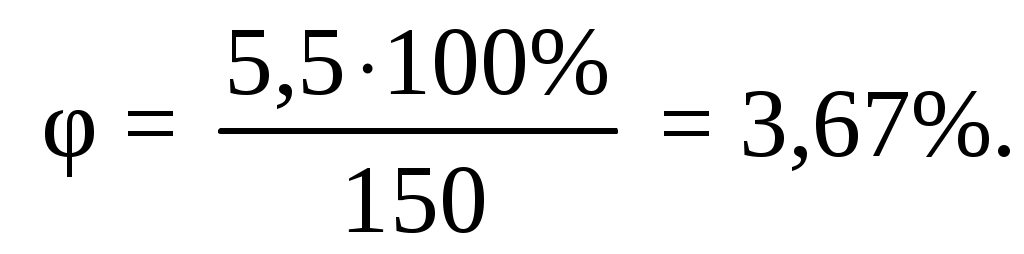
Ответ: так как концентрационные пределы воспламенения циклобутана в воздухе 1,72 ˂ 3,67˂ 4,99, при полном испарении циклобутана концентрация его паров в воздухе будет взрывоопасной.
5. Оценить температурные пределы воспламенения насыщенных паров жидкости из п.4 в воздухе при нормальном атмосферном давлении. Определить класс жидкости по степени пожароопасности. Сравнить с табличными данными.
Решение:
Найдем давление насыщенных паров горючей жидкости при концентрации равной НКПР и нормальном давлении:
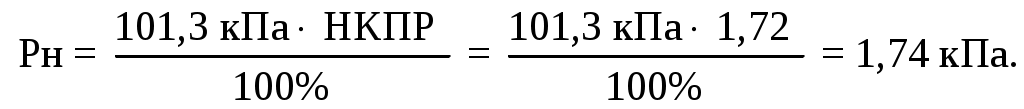
Найдем температуру, когда жидкость будет иметь давление насыщенных паров горючей жидкости при концентрации равной НКПР и нормальном давлении. Из справочных таблиц коэффициенты Антуана - А, В, СА – для циклобутана равняются соответственно 6,8450; 1024,2 и 241.
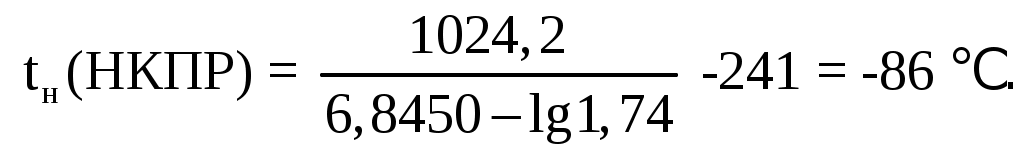
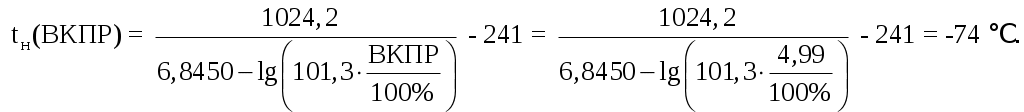
Ответ: tн(НКПР) = -86℃; tн(ВКПР) = -74℃.
6. Для выполнения требований пожарной безопасности предприятие приобрело прибор контроля концентрации взрывоопасных газов и паров. Необходимо проверить его работоспособность или провести техническое обслуживание. Произвести расчет температуры и количества жидкости из п.5, необходимые для создания в тестовой камере объемом 10 литров паровоздушной смеси с концентрацией 50%НКПР для определения основной абсолютной погрешности газоанализатора.
Решение:
Найдем 50%НКПР циклобутана: 1,72/ 2 = 0,86%.
Найдем давление насыщенных паров пропилена при концентрации равной 50%НКПР и нормальном давлении:
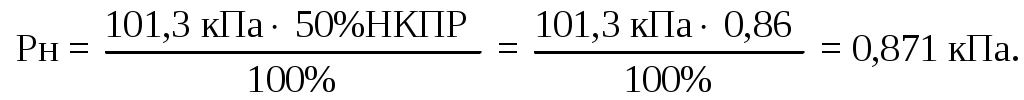
Рассчитаем температуру с использованием уравнения Антуана:
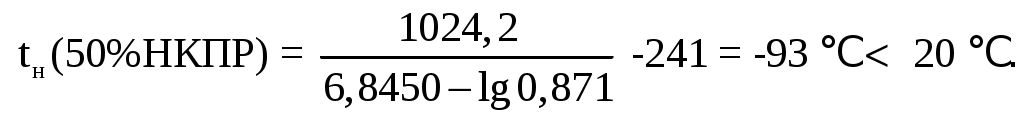
Найдем объем вещества и количество
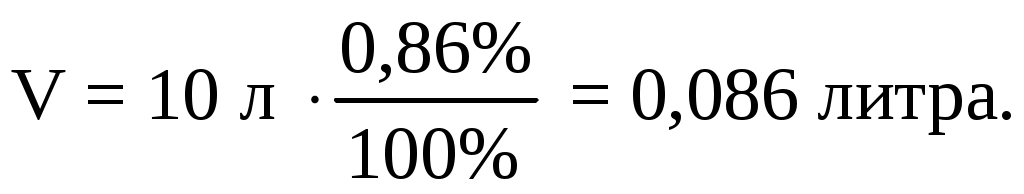
В стандартных условиях (ГОСТ 2939–63):
количество молей: 0,086/24,22= 0,0036 молей
масса составляет: 0,0036 молей· 56 г/моль = 0,2016 г 202 мг.
Ответ: масса составит 202 мг.
Контрольные вопросы
Вопрос 1. Дайте понятие о нижнем и верхнем концентрационных пределах распространения пламени.
Ответ: НКПР - нижний концентрационный предел распространения пламени – минимальная концентрация горючего газа в однородной смеси с окислителем, при которой возможно распространение пламени по смеси. Если концентрация горючего газа в смеси меньше НКПР, смесь не способна к распространению пламени, поскольку при горении такой «бедной» смеси выделяется так мало тепла, что его не хватает для прогрева и воспламенения остальных объемов газа.
ВКПР - верхний концентрационный предел распространения пламени – максимальная концентрация горючего газа в однородной смеси с окислителем, при котором возможно распространение пламени по смеси. Если концентрация горючего вещества в смеси превышает ВКПР, то количества окислителя в смеси недостаточно для полного сгорания горючего газа.
Область воспламенения - диапазон концентраций, находящийся выше нижнего (НКПР) и ниже верхнего (ВКПР) пределов воспламенения. Горючий газ, концентрация которого находится в пределах этой ограниченной области, способен воспламеняться от искры, вызванной обыкновенным статическим электричеством или трением.
Смесь с концентрацией горючего газа, входящей в область воспламенения, является взрывоопасной. Чем шире диапазон области воспламенения и ниже НКПР, тем более взрывоопасен горючий газ.
Вопрос 2. Что такое насыщенные пары и чем характеризуются?
Ответ: Насыщенный пар - это пар, находящийся в термодинамическом равновесии с жидкостью или твердым телом того же состава.
Насыщенный означает, что данный объект имеет самое большое из возможных значений некоторых параметров. Для пара — это плотность (ρн) и давление (рн). Значение давления насыщенного пара и его плотности являются максимальными при заданном значении температуры. Если это не так, то пар ненасыщенный. Чем дальше пар от насыщения, тем меньше эти величины.
Вопрос 3. От чего зависит характеристика насыщенных паров?
Ответ: 1. При неизменной температуре плотность насыщенного пара не зависит от его объема. Если, например, насыщенный пар изотермически сжимать, то его плотность в первый момент возрастет, скорость конденсации превысит скорость испарения, и часть пара конденсируется в жидкость — до тех пор, пока вновь не наступит динамическое равновесие, в котором плотность пара вернется к своему прежнему значению. Аналогично, при изотермическом расширении насыщенного пара его плотность в первый момент уменьшится (пар станет ненасыщенным), скорость испарения превысит скорость конденсации, и жидкость будет дополнительно испаряться до тех пор, пока опять не установится динамическое равновесие — т. е. пока пар снова не станет насыщенным с прежним значением плотности.
2. Давление насыщенного пара не зависит от его объема. Это следует из того, что плотность насыщенного пара не зависит от объема, а давление однозначно связано с плотностью
3. При неизменном объеме плотность насыщенного пара растет с повышением температуры и уменьшается с понижением температуры. Действительно, при увеличении температуры возрастает скорость испарения жидкости. Динамическое равновесие в первый момент нарушается, и происходит дополнительное испарение некоторой части жидкости. Пара будет прибавляться до тех пор, пока динамическое равновесие вновь не восстановится. Точно так же при понижении температуры скорость испарения жидкости становится меньше, и часть пара конденсируется до тех пор, пока не восстановится динамическое равновесие — но уже с меньшим количеством пара. Таким образом, при изохорном нагревании или охлаждении насыщенного пара его масса меняется, поэтому закон Шарля в данном случае не работает. Зависимость давления насыщенного пара от температуры уже не будет линейной функцией.
4. Давление насыщенного пара растет с температурой быстрее, чем по линейному закону.
Вопрос 4. Как называется прибор контроля выполнения требований пожарной безопасности?
Ответ: Для выполнения требований пожарной безопасности используют прибор контроля концентрации взрывоопасных газов и паров (газоанализатор).
Газоанализатор — измерительный прибор, анализатор для определения качественного или количественного состава смесей газов.
Существуют газоанализаторы ручного действия и автоматические. Среди первых наиболее распространены абсорбционные газоанализаторы, в которых компоненты газовой смеси последовательно поглощаются различными реагентами. Автоматические газоанализаторы непрерывно измеряют концентрацию взрывоопасных газов и паров газовой смеси.
|
|
|
 Скачать 126.5 Kb.
Скачать 126.5 Kb.