доклад. При этом необходимо было решить следующие задачи
 Скачать 79.31 Kb. Скачать 79.31 Kb.
|
|
Исследования воздействия инсулинового шока необходимо при инсулинотерапии, а также для поисков новых способов лечения заболеваний человека, связанных с гиперинсулинемией. Возрастающий интерес исследователей к проблеме гиперинсулинемии обусловлен, прежде всего, тем, что осложнения, вызванные или сопутствующие данному состоянию, могут привести к серьезным отдаленным отрицательным последствиям для здоровья человека Клиническая значимость нарушений, объединенных рамками гиперинсулинемического состояния, заключается в том, что их сочетание в значительной степени ускоряет развитие и прогрессирование заболеваний, таких как СД2, МС, СПЯ. Целью выпускной работы было влияние гиперинсулинемии на отдельные биохимические показатели сыворотки крови и гомогенат тканей желудка, печени, мышечной и нервной тканях. При этом необходимо было решить следующие задачи: Определить уровень окислительной модификации белков в сыворотке крове лабораторных крыс при воздействии инсулинового шока. Установить содержание продуктов окислительной модификации белков в гомогенате нервной ткани. Провести анализ содержания продуктов окислительной модификации белков в гомогенате мышечной ткани лабораторных крыс. Исследовать уровень окислительной модификации белков в ткани печени лабораторных крыс. Выяснить содержание продуктов окислительной модификации белков в гомогенате тканей желудка лабораторных крыс. В выпускной работе использовался метод определения окислительной модификации белков Принцип метода основан на реакции взаимодействия окисленных аминокислотных остатков белка с 2,4 – динитрофенилгидразином (2,4 – ДНФГ) с образованием призводных 2,4 – ДНФГ [8]. Для анализа использовали 0,1 мл сыворотки крови. Добавляли 0,9 мл 20% раствора трихлоруксусной кислоты (ТХУ). К денатурированным белкам приливали равный объем (1 мл) 0,1% 2,4 – ДНФГ, растворенного в 2М HCl. В контрольную пробу добавляли вместо 2,4 – ДНФГ равный объем 2М HCl. Инкубацию осуществляли при комнатной температуре в течение 1 часа. Затем пробы центрифугировали при 3000g в течение 15 – 20 мин. Осадок промывали 3 раза раствором этанол-этилацетат (1:1) для экстракции липидов и 2,4 – ДНФГ, который не реагировал с карбонильными группами окисленных белков. Полученный осадок подсушивали с целью устранения оставшегося растворителя этанол-этилацетат и затем растворяли в 8М растворе мочевины. Мочевину приливали к осадку в объеме 2,5 мл и выдерживали в кипящей водяной бане в течение 5 минут до полного растворения. Оптическую плотность регистрировали на спектрофотометре СФ – 16 при длинах волн 356, 370, 430 и 530 нм. Уровень окислительной модификации в I группе дстоаерно выше, чем в других группах и достоверно ниже, чем в контрольной группе. Во II и III группах прослеживается дальнейшее снижение уровня окислительной модификации. Вероятно, это связано с окислением альдегидных и кетоновых групп до карбоксильных, чем и вызвано уменьшение регистрации данных продуктов. Возможно, сыворотка проявляет наименьшую устойчивость к воздействию инсулинового шока. Чем больше воздействия, тем в большей степени проявляется гиперинсуленимия. Кровь является многокомпонентной средой, возможно, поэтому воздействие гиперинсулинемии активирует окислительные процессы и приводит к окислительной модификации белков. На I и II сутки воздействие инсулина наблюдается снижение уровня окислительных белков по сравнению с интактной группой. Однако дальнейший показатель возрастает по сравнению с предыдущими группами, тем не менее, не достаточно до контрольной группы. Что показывает об усилении окисления в нервной ткани при гиперинсулинемии. Также полученные результаты могут показывать о накопительном характере продуктов окислительной модификации в нервной ткани. В исследуемых группах наблюдается достоверное снижение уровня окислительной модификации белков. В мышечных тканях окислительная модификация носит однотипный характер. На II и III сутки уровень не меняется и наблюдается стационарность. Что свидетельствует о высоком содержании гликогена в поперечнополосатых мышечных тканях. Значительное уменьшение окислительной модификации белков происходит в I сутки воздействия вороженной гиперинсулинемии в 3 раза, что может являться свидетельством того что в печени идут усиленные окислительные процессы. При сравнении результатов с другими тканями, данные свидетельствуют о том, что в печени особенно интенсифицируются окислительные процессы. Можно сформировать две теории: Вероятно, во II и III будут подвергаться воздействию более устойчивые ткани печени. Ткань печени стабилизирует гомеостатические функции активности и выводит на уровень интактной группы, который представляет собой механизм детоксикации, поддерживающий постоянство состава крови. Содержание продуктов окислительной модификации понижается на 10% в опытных группах при всех регистрирующихся длин волн по сравнению с интактной группой. После воздействия выраженной гиперинсулинемии по представленным данным можно свидетельствовать, что желудок является инертным. Гладкая мышечная ткань проявляет устойчивость к воздействию выраженного инсулинового шока, в отличие от поперечнополосатой мышечной ткани, причиной которой является значительно меньше содержание миоглобина. Также высокой устойчивостью отличается внутренняя среда желудка, так как пептидная структура инсулина разрушается кислым содержимым. Инсулин – белковый гормон. Аминокислотная последовательность инсулина была впервые расшифрована Ф. Сангером (Sanger) в 1955 г. Молекула инсулина состоит из двух полипептидных цепей: А (21 аминокислотных остатков) и В (30 аминокислотных остатков), соединенных между собой дисульфидными мостиками. Дополнительный дисульфидный мостик соединяет два остатка цистеина в положениях 6 и 11 А-цепи [14, 21, 34]. Инсулин обладает видовой специфичностью, что определяется его химической структурой, различиями в последовательности аминокислотных остатков в молекуле. От этого зависит иммунология инсулина. Основным стимулятором секреции эндогенного инсулина является глюкоза. Допускают две альтернативные возможности стимулирования глюкозой секреции инсулина. Предполагается, что глюкоза, участвуя в обменных процессах внутри β-клетки, усиливает ее функцию. Второй возможностью является взаимодействие глюкозы с рецептором («глюкорецептор») на мембране β-клетки и тем самым стимулирование секреции инсулина [21]. Кроме самой глюкозы, большое значение в секреции инсулина придается эндокринному регулированию функции островков Лангерганса. До двух третей инсулина, секретируемого обычно на прием пищи, как полагают, происходит из-за инсулинотропного действия так называемых гормонов инкретинов. Инсулин – главный регулирующий обмен веществ в организме гормон. Хотя его действие многонаправленно, конечным результатом является обеспечение энергетических и пластических процессов. Место действия инсулина – печень, мышечная и жировая ткань [21]. После действия инсулин быстро подвергается разрушению ферментом печени инсулиназой. Влияние гормона в основном направлено на обмен углеводов и проявляется снижением уровня глюкозы в крови (гипогликемический эффект) [13]. Это обусловлено тем, что инсулин облегчает переход глюкозы из крови в клетки, повышая проницаемость клеточных мембран и активируя ее дальнейший распад. Скорость поступления глюкозы внутрь клетки возрастает в 20 – 40 раз. Происходит это за счет 5 – 10-кратного увеличения содержания белков – транспортеров глюкозы на поверхности мембраны, при одновременном уменьшении их содержания внутри клетки на 50 – 60% [24]. Инсулин оказывает антикатаболическое и анаболическое дествие (наряду с гормоном роста). Антикатаболические эффекты инсулина в печени проявляются снижением процессов гликогенолиза (разрушение гликогена), глюконеогенеза (образование кетоновых тел). В жировой ткани он подавляет процессы липолиза (распад жиров), а в мышечной – распада белков. Анаболическое действие инсулина связано с обеспечением синтеза гликогена и жирных кислот в печени, синтеза глицерина в жировой ткани и усиления поглощения аминокислот и синтеза белка и гликогена в мышцах. Эти эффекты могут осуществляться инсулином как автономно, так и путем стимуляции им секреции соматотропного гормона. Инсулин усиливает поглощение глюкозы печенью, жировой и мышечной тканью. Около 60% глюкозы, поступающей в организм здорового человека в состоянии покоя, поглощается печенью, 15% утилизируется периферическими тканями. Механизм действия инсулина связан с активацией различных ферментов, участвующих в фосфорилировании глюкозы (гексо- и глюкокиназы) и других соединений, включенных в процессы гликолиза. Активность этих ферментов определяется присутствием инсулина. Недостаток инсулина приводит к снижению гликолиза и тем самым снижению образования энергетических веществ, необходимых организму для жизнедеятельности и пластических процессов [21]. Таким образом, инсулин имеет большое значение для поддержания содержания сахара и свободных жирных кислот в крови на относительно постоянном уровне, для регуляции содержания гликогена в печени гликемического гомеостаза [5]. Содержание глюкозы во внутренней среде организма должно находиться в строго ограниченных пределах. Так, натощак концентрация глюкозы в плазме крови колеблется в пределах 60 – 90 мг% (нормогликемия), увеличивается до 100 – 140 мг% (гипергликемия) в течение одного часа после еды и обычно в течение двух часов возвращается к нормальным значениям [28]. Печень действует как первая буферная система; она удаляет поступающие по воротной вене моносахариды, образующиеся при переваривании пищи, и превращает их в глюкозу, а затем в гликоген. Поступление избытка глюкозы приводит к повышению ее концентрации в общем кровотоке, что в свою очередь стимулирует поглощение глюкозы периферическими тканями. Достигая поджелудочной железы, избыточная концентрация глюкозы крови стимулирует выделение инсулина клетками островков Лангерганса; инсулин вызывает дальнейшее усиление поглощения глюкозы периферическими тканями [22]. Существуют ситуации, когда концентрация глюкозы в плазме крови уменьшается до 60 мг% и ниже (гипогликемия). Гипогликемия может возникать у здоровых лиц через несколько дней голодания. Клиническая гипогликемия проявляется при снижении уровня глюкозы ниже 2,4 – 3,0 ммоль/л [28]. При кратковременной гипогликемии развиваются симптомы, обусловленные избыточным выбросом адреналина как компенсаторной реакцией, направленной на ликвидацию гипогликемии путем активации гликогенолиза и глюконеогенеза, – потливость, тахикардия, нервозность и чувство голода. При более продолжительной гипогликемии возникает мозговое расстройство: возбуждение, головная боль, нарушения сознания, психотические расстройства. Крайнее проявление гипогликемии – гипогликемическая кома. Необходимость поддержания постоянной концентрации глюкозы в крови диктуется тем, что мозг, сетчатка и некоторые другие клетки и органы в качестве источника энергии используют преимущественно глюкозу. Так, в периоды между приемами пищи основная часть глюкозы, находящаяся во внутренней среде организма, используется для метаболизма мозга [28]. Известен и другой тип изменения обмена веществ, характеризующийся повышенной секрецией инсулина, – гиперинсулинемия. Гиперинсулинемия, наряду с ожирением, гипергликемией, глюкозурией, кетонемией, снижением толерантности к глюкозе и инсулину, характерна для такого заболевания как инсулинонезависимый диабет 2 типа. Для экспериментального изучения этого состояния удобной моделью могут служить мыши и крысы с наследственным гипергликемическим ожирением. У мышей и крыс с генетически обусловленным синдромом гипергликемического ожирения в скрытой фазе наблюдается повышение содержания инсулина в крови, резкое увеличение его секреции в ответ на введение глюкозы, усиление окисления глюкозы до углекислоты на уровне организма и увеличение толерантности к глюкозе. Непосредственной причиной гиперинсулинемии служит гипертрофия инсулярного аппарата и стимуляция секреции инсулина. Инсулинорезистентность и гиперинсулинемия, с одной стороны, и повышение в крови жирных кислот и триглицеридов (как источников свободных жирных кислот) развивается синхронно и задолго до возникновения гипергликемии и ожирения. В одной из гипотез постулируется эссенциальная роль триглицеридов в генезе инсулинорезистентности. Гипертриглицеридемия, возникающая первично при ожирении и диабете 2 типа, вызывает с помощью липопротеидов очень низкой плотности инсулинорезистентность, которая приводит к усилению секреции инсулина и гиперинсулинемии [17]. Гиперинсулинемия является патологическим состоянием организма, характерным для некоторых заболеваний человека: синдром поликистозных яичников, метаболический синдром, органический гиперинсулинизм, сахарный диабет 2 типа и др. Патогенетические факторы, ведущие к развитию сахарного диабета 2 типа, прямо связаны с формированием у больных повышенного артериального давления. Хотя не все вопросы решены, накопленные данные свидетельствуют о том, что инсулин и инсулинорезистентность (недостаточный ответ тканей-мишеней на инсулин) являются существенными компонентами системы регуляции артериального давления [2, 3, 12, 16, 18, 23, 27, 35]. Сегодня установлен целый ряд заболеваний сердечно-сосудистой системы, при которых отмечены гиперинсулинемия и инсулинорезистентность, например, ишемическая болезнь сердца, артериальная гипертензия. Хроническое повышение уровня инсулина на 20 – 30% может отрицательно влиять на возникновение и течение указанных сердечно-сосудистых заболеваний. Экспериментальные данные показали, что хроническая гиперинсулинемия приводит к развитию системного артериосклероза вследствие стимулируемой инсулином пролиферации гладкомышечной и соединительнотканной оболочек артериальной стенки. Это в свою очередь приводит к ее регидности, сужению просвета артерий и артериол на значительном их протяжении, увеличению общего периферического сопротивления, гипертензии и последующей гипертрофией миокарда [26, 29, 30, 31, 32, 33]. Рядом исследователей установлена связь гиперинсулинемии с прогрессированием макроангиопатий. Высокий уровень инсулина наблюдается у больных диабетом, страдавших ожирением. А также при неадекватной инсулинотерапии у больных инсулинозависимой формой этого заболевания [4]. Метаболический синдром (МС), сахарный диабет 2-го типа (СД2) и поликистоз яичников (ПЯ), относятся к наиболее актуальным болезням современной медицины. Также заболевания сердечно-сосудистой системы продолжают лидировать в структуре заболеваемости и смертности населения во всем мире. Возникновение всех этих болезней зависит от образа жизни и генетической предрасположенности. Согласно данным Всемирной организации здравоохранения МС, СД2 и ПЯ распространены больше в индустриальных странах. Объединяющая основа вышеперечисленных болезней состоит в инсулинорезистентности и сопутствующей ей гиперинсулинемии. Таким обазом исследования воздействия инсулинового шока необходимо при инсулинотерапии, а также для поисков новых способов лечения заболеваний человека, связанных с гиперинсулинемией. Новым направлением стало исследование окислительной модификации белков (ОМБ) при различных патологических состояниях [1-12]. Для определения продуктов ОМБ обычно используется метод, описанный Е.Е. Дубининой и соавт., [6] предусматривающий регистрацию 2,4- динитрофенилгидразонов основного и нейтрального характера в плазме (сыворотке) крови. Определяют динитрофенилгидразоны, образующиеся при спонтанной и/или металл-катализируемой ОМБ. В последнее время содержание окисленных белков стали определять в клетках крови [12] и в тканях [13]. В качестве основных индукторов ОМБ, в первую очередь, рассматриваются активные формы кислорода (АФК), увеличение свободного железа, продукты перекисного окисления липидов при снижении антиоксидантной защиты. При действии АФК происходит нарушение нативной конформации белков с образованием крупных белковых агрегатов или фрагментация белковой молекулы. Гидроксильный радикал чаще всего вызывает агрегацию белков, а в комбинации с супероксиданионом - фрагментацию с образованием низкомолекулярных фрагментов. Радикалы липидов могут также вызывать фрагментацию белковых молекул. Механизм формирования агрегатов следующий: при действии оксидантов происходит нарушение нативной конформации ряда доменов белков. В результате увеличивается число гидрофобных остатков на поверхности глобул, что и обуславливает формирование крупных белковых конгломератов [14]. 2,4-Динитрофенилгидразин — кристаллическое вещество красного цвета.  Общие свойства 2,4-Динитрофенилгидразина Общие свойства 2,4-Динитрофенилгидразина
Получение 2,4-динитрофенилгидразин получают реакцией 2,4-динитрохлорбензола с гидразином в триэтиленгликоле[1] или 2,4-динитрохлорбензола с сульфатом гидразина. 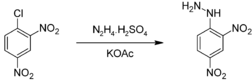 Другим способом получения динитрофенилгидразина может служить восстановление солей динитрофенилдиазония сульфитом натрия с последующим гидролизом полученного соединения концентрированной соляной кислотой[2]. (NO2)2C6H3N2Cl + Na2SO3 → (NO2)2C6H3N(SO3)NHSO3 (NO2)2C6H3N(SO3)NHSO3 + HСl → (NO2)2C6H3NHNH2 • HCl Применение Реакция динитрофенилгидразина с альдегидами и кетонами используется в аналитической химии для определения этих соединений. Образующиеся в результате конденсации кристаллические гидразоны можно идентифицировать по температуре их плавления[3].  Также 2,4-динитрофенилгидразин используется в процессе синтеза кортизона из дезоксихолевой кислоты для дегидрогалогенирования промежуточного бромкетона.  Гликоген — (C6H10O5)n, полисахарид, образованный остатками глюкозы, связанными α-1→4 связями (α-1→6 в местах разветвления); основной запасной углевод животных. Гликоген является основной формой хранения глюкозы в животных клетках. Откладывается в виде гранул в цитоплазме во многих типах клеток (главным образом печени и мышц). Гликоген иногда называется животным крахмалом, так как его структура похожа на амилопектин — компонент растительного крахмала. В отличие от крахмала, гликоген имеет более разветвленную и компактную структуру, не дает синей окраски при окраске йодом. Гликоген образует энергетический резерв, который может быть быстро мобилизован при необходимости восполнить внезапный недостаток глюкозы. Гликогеновый запас, однако, не столь ёмок в калориях на грамм, как запас триглицеридов (жиров). Только гликоген, запасённый в клетках печени (гепатоциты) может быть переработан в глюкозу для питания всего организма, при этом гепатоциты способны накапливать до 8 процентов своего веса в виде гликогена, что является максимальной концентрацией среди всех видов клеток. Общая масса гликогена в печени может достигать 100—120 граммов у взрослых. В мышцах гликоген перерабатывается в глюкозу исключительно для локального потребления и накапливается в гораздо меньших концентрациях (не более 1 % от общей массы мышц), в то же время его общий мышечный запас может превышать запас, накопленный в гепатоцитах. Небольшое количество гликогена обнаружено в почках, и ещё меньшее — в определённых видах клеток мозга (глиальных) и белых кровяных клетках. В качестве запасного углевода гликоген присутствует также в клетках грибов. Инсули́н (от лат. insula — остров) — гормон пептидной природы, образуется в бета-клетках островков Лангергансаподжелудочной железы. Оказывает многогранное влияние на обмен практически во всех тканях. Основное действие инсулина заключается в снижении концентрации глюкозы в крови. Инсулин увеличивает проницаемость плазматических мембран для глюкозы, активирует ключевые ферментыгликолиза, стимулирует образование в печени и мышцах из глюкозы гликогена, усиливает синтез жиров и белков. Кроме того, инсулин подавляет активность ферментов, расщепляющих гликоген и жиры. То есть, помимоанаболического действия, инсулин обладает также и антикатаболическим эффектом. Нарушение секреции инсулина вследствие деструкции бета-клеток — абсолютная недостаточность инсулина — является ключевым звеном патогенеза сахарного диабета 1-го типа. Нарушение действия инсулина на ткани — относительная инсулиновая недостаточность — имеет важное место в развитии сахарного диабета 2-го типа. Молекула инсулина образована двумя полипептидными цепями, содержащими 51 аминокислотный остаток: A-цепь состоит из 21 аминокислотного остатка, B-цепь образована 30 аминокислотными остатками. Полипептидные цепи соединяются двумя дисульфидными мостиками через остатки цистеина, третья дисульфидная связь расположена в A-цепи. Первичная структура инсулина у разных биологических видов несколько различается, как различается и его важность в регуляции обмена углеводов. Наиболее близким к человеческому является инсулин свиньи, который различается с ним всего одним аминокислотным остатком: в 30 положении B-цепи свиного инсулина расположеналанин, а в инсулине человека — треонин; бычий инсулин отличается тремя аминокислотными остатками. Инсулинотерапия Существует 3 основных режима инсулинотерапии. У каждого из них имеются свои преимущества и недостатки. У здорового человека секреция инсулина бета-клетками происходит постоянно и составляет около 1 ЕД инсулина в 1 ч, это так называемая базальная (базисная) или фоновая секреция для подавления работы альфа-клеток, продуцирующих основного антагониста инсулина Глюкагон. Во время еды происходит быстрое (болюсное) повышение концентрации инсулина во много раз. Стимулированная секреция инсулина составляет приблизительно 1—2 ЕД на каждые 10 г углеводов (цифра весьма вариабельна — даже у одного и того же человека она различна в разное время суток и во многом зависит от состояния организма в данный момент времени). При этом устанавливается динамическое равновесие: поддерживается постоянный баланс между концентрацией инсулина и потребностью в нём (по механизму обратной связи) выбросом «контринсулярных» гормонов — естественного гормона-антагониста инсулина — Глюкагона и других. Больной сахарным диабетом 1-го типа нуждается в заместительной инсулинотерапии, которая бы имитировала секрецию инсулина в физиологических условиях. Существуют традиционная схема инсулинотерапии и интенсифицированная инсулинотерапия. Необходимо использовать различные виды препаратов инсулина — задача одних постоянное подавление естественных антагонистов инсулина и посреднические функции в передаче действия гормона роста на клетки (инсулиноподобные факторы роста или соматомедин C), а задача других (короткого действия) компенсировать постпрандиальную гипергликемию (повышение уровня углеводов в циркулирующей крови после приёма пищи). Добиться компенсации углеводного обмена однократным введением препарата инсулина у больных сахарным диабетом 1-го типа невозможно. Количество инъекций варьирует от 2 (фиксированной готовой смеси препаратов инсулина короткого действуия и NPH) до 5—6 разового введения препаратов инсулина короткого действия в сутки (без применения NPH-инсулина). Чем больше число инъекций, тем режим инсулинотерапии максимальнее имитирует физиологический. |
