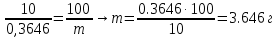0282_Бобрик_ЛР№5. Приготовление раствора электролита заданной концентрации
 Скачать 26.14 Kb. Скачать 26.14 Kb.
|
|
ИНОБРНАУКИ РОССИИ Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина) Кафедра физической химии отчет по лабораторной работе №5 по дисциплине «Химия» Тема: Приготовление раствора электролита заданной концентрации
Санкт-Петербург 2020 Цель работы: приготовление р-ра соляной кислоты, нахождение его точной концентрации, определение общего содержания щёлочи в р-ре, выданном преподавателем и, на основании известной концентрации выданного р-ра, рассчитать объём. Основные теоретические положения Раствор – это гомогенная система, содержащая не менее двух веществ. Существуют растворы твердых, жидких и газообразных веществ в жидких растворителях, а также однородные смеси (растворы). Электролит – это вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит в растворах и расплавах, или движения ионов в кристаллических решётках твёрдых электролитов. Концентрация – это величина, количественно характеризующая содержание компонента относительно всей смеси. Способы выражения концентрации: Массовая доля – это отношение массы этого вещества к общей массе смеси.  Молярная концентрация (молярность) – молярная концентрация растворенного вещества, выражается числом молей растворенного вещества, содержащихся в 1 л раствора, (моль/л): 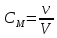 Нормальная концентрация (нормальность) – выражается числом молей эквивалентов растворенного вещества, содержащихся в 1 л раствора (моль-экв/л):  Моляльная концентрация (моляльность) – выражается числом молей растворенного вещества, которое приходится на 1000 г растворителя (моль/(1000 г растворителя)): 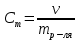 Титр – выражается числом граммов растворенного вещества, содержащихся в 1 мл раствора (г/см3): 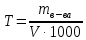 Молярная (мольная) доля – это отношение количества молей данного компонента к общему количеству молей всех компонентов, выражается в долях от единицы. 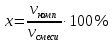 Протокол наблюдений Сн(Na2CO3)= 0.345 н
Сʹн(KOH)= 0.734 н Обработка результатов 1. Расчет объема концентрированного раствора соляной кислоты, необходимого для приготовления 0.1 н раствора соляной кислоты Необходимо приготовить VHClразб – 100 мл раствора 0.1 н раствора HCl из концентрированного раствора соляной кислоты, массовая доля которой ωHClконц – 10 % (ρHClконц=1,05 г/см3).
2. Определение концентрации приготовленного раствора HCl путем титрования раствором Na2CO3: 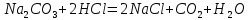  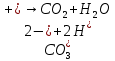 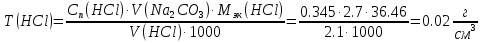 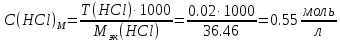 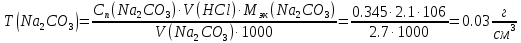 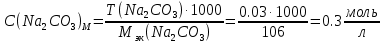 3. Определение объема раствора KOH, выданного преподавателем Расчет молярной концентрации и титра приготовленного раствора KOH: 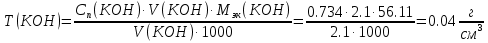 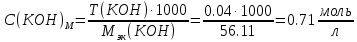 Определение общего содержания щелочи, выданной преподавателем: 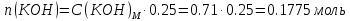 Вычисление объема раствора KOH, выданного преподавателем: VʹKOH = формула = расчетные значения = ответ [единицы измерения] 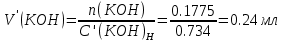 Расчет абсолютной и относительной погрешностей в определении концентрации HCl и объема раствора KOH: Снтеор HCl = 0.1 н абсолютная погрешность:  относительная погрешность:  Vʹтеор KOH =7 мл абсолютная погрешность:  относительная погрешность:  Выводы: мы приготовили раствор соляной кислоты, нашли его точную концентрацию, определили общее содержание щелочи в растворе, выданном преподавателем, и на основании известной концентрации выданного раствора рассчитали его объем. |