Протопластарды бөліп алу. реферат. Протопластарды бліп алу
 Скачать 1.02 Mb. Скачать 1.02 Mb.
|
|
Протопластарды бөліп алу Осмотик ретінде сахароза, маннит, сорбит қолданылады. Осы заттардың гипертониялық ерітінділері әсерінен вакуоль сусызданып жиырылып, протопласт көлемі кішірейіп, соңынан қабықтан алшақтайды. Кейде жасуша сопақ болғанда протопласт плазмолиз кезінде екі бөлініп кетуі мүмкін. Сондай ядросы жоқ субпротопласт цитопласт деп аталады.1968 жылы жапон ғалымы Такебе темекі жапырағынын мезофилл жасушаларынан протопластарды көп мөлшерде алудың тиімді әдісін жете зерттеп дайындады. Алдымен жапырақты 70 %-тік этанолда стерильдейді, кейін 15-20 мин 10 %-тік кальций гипохлоритінде ұстап, дистильденген суда шайып алады. Астыңғы эпидермисті алып тастап, жапырақты майда бөліктерге кесіп, пектиназа ферментінің ерітіндісіне салады. Пектиназа жасушааралыққабаттың заттарын ерітеді, яғни мацерация өтеді. Одан кейін объект целлюлаза ферментінін ерітіндісімен өнделеді, бұл кезде целлюлозалықжасушақабығы біржолата жойылады. Ферментерітіндісіне осмостық зат қосылады. Осы әдіспен әр түрлі өсімдіктердіңұлпаларынан протопластар алынады. Қазіргі уақытта протопластарды бөліп алу үшін ферменттердің қоспасын пайдаланады. Бұл қоспаның құрамында ферменттердің үш түрі болады пектиназалар, целлюлазалар және гемицеллюлазалар. Олар жасушақабығының негізгі компоненттерін ыдыратады. Ферменттік ерітінділерді арнайы сүзгіден өткізу арқылы залалсыздандырады. Жасуша түрлерінде құрылымы мен құрамы жағынан айырмашылықтары болғандықтан, қолданылатын ферменттердің комбинациялары мен мөлшерінің ара қатынасы бірдей болмайды. Әрбір ұлпа үшін ферменттердің құрамы, концентрациясы мен ара қатынасы және өндеу уақыты бөлек іріктеліп алынады. Бөлініп алынған протопластар ферменттік ерітіндіде мейлінше аз уақыт болуы керек, одан кейін ұқыпты түрде жуылуы қажет. Протопластарды бөлу кезінде осмостық стабилизатор маңызды қызмет атқарады. Протопластар бүтін болу үшін ферменттік ерітінділер изотониялық немесе гипертониялық күйде болу керек. Кейде материалды алдын ала плазмолиздық ертіндісінде біраз ұстайды. Осмостық зат ретінде көбінесе қанттар (глюкоза, сахароза, сорбит, маннит) пайдаланылады, кейде СаС12, Ма2НРО4, КСІ тұздардын ерітіндісі 0,3-0,8 М концентрацияда қолданылады. Осмостық заттың дәл концентрациясы өсімдіктің нақтылы түріне және онын физиологиялық күйіне байланысты жеке іріктеліп алынады. Көбінесе ферменттер кейін протопластарды өсіруге қолданылатын қоректік ортада ерітіліп дайындалады. Ферменттікерітіндінің рН көрсеткішін бір деңгейде (5,4-6,2) ұстау үшін буфер қосады. Протопластарды бөлу кезінде аэрацияның маңызы зор. Сондықтан ортаны араластыратын жабдықтар қолданылады немесе ферменттік ерітінді түбіне ғана құйылған Петри табақшасында бөліп шығарады. Протопластарды ала көленкеде немесе қараңғыда бөліп алады. Ферменттік ерітіндіде инкубация уақыты ферменттердің үйлесуіне, рН және температураға байланысты, 1-2 сағаттан 15-16 сағатқа дейін барады. Әрбір нақтылы ұлпа үшін ең тиімді температурамен өндеу уақытын жеке іріктеп алу қажет. Температура әр деңгейде болады, мысалы бидайға 14°С болса, томатқа ең қолайлысы 27°С. Протопластар бөлініп алынған сон, олар ұлпаныңқалдықтары мен ферменттерден тазалануы керек. Ол үшін оларды центрифугалайды немесе сүзіп алады. Инкубациялыққоспаны тесіктері 50-100 мкм електен сүзеді, одан кейін протопласт суспензиясын центрифугалайды. 2. Протопластарды нәтижелі бөліп алу көптеген факторларға байланысты. Олар атап айтқанда: ұлпаның шығу тегі (жапырақ, тұқымжарнақ, тамыр, тозаң түйірі, каллус ұлпасы, суспензиядағы жасушалар), өсімдіктің түрі мен сорты, өсімдіктің физиологиялық күйі, ферменттердің құрамы, олардың сапасы, ортаның рН және осмостық заттың түрі. Протопластардың тіршілікке икемділігін, яғни олардын метаболиттік активтігін анықтайтын арнайы әдіс бар. Ол протопластардын флуоресцеиндиацетатпен (ФДА) боялуы. ФДА - бұл флуоресценциясы жоқ қосылыс, протопластар мембранасы арқылы жеңіл өтеді, тірі протопластардың ішінде эстеразалардың әсерімен ыдырайды. Протопластар суспензиясының сапасы тіршілікке икемді протопластардың санымен (процент мөлшерінде) белгіленеді. Протопластардың саны Фукс-Розенталь камерасында есептеледі. Протопластардың тығыздығы (суспензиянын 1 мл-дегі саны) суспензияның маңызды сипаттамасы. Егер ұлпаның немесе өсірілген жасушалардың ылғалды массасының 1 граммынан 1005 тен ІхІО'1 дейін тіршілікке икемді протопластар шықса, онда протопластар жақсы бөлініп алынды деп есептеледі. Протопластарды көп мөлшерде тұрақты алып отыру үшін өсімдіктерді белгілі бір жағдайда өсіру керек және олардың ең қолайлы өсу кезеңің нақтылы бір жағдайын анықтап таңдап алу қажет. Іп vitro өскен жасушалар мен ұлпалардан протопластарды бөліп алудың мынадай өз артықшылықтары бар: стерильдік, іп vitroжағдайында өсуге бейімділік. Бірақ жасуша қабықшасының химиялық құрамының күрделі болып өзгеруі және онын калыңдауы ферменттік гидролизді қиындатады. Бүтін протопластардың бөлініп алынуы өсірген жасушалардың ішінде меристемалық жасушаларының сан жағынан үлесіне сай болады, ал ол үшін суспензиядағы жасушаларды жиі-жиі (әрбір 2-3 тәулігінде) жаңа коректік ортаға көшіріп отыру керек. Суспензияда өсірген жасушалардан протопластарды алу үшін ең қолайлы мезгіл, ол жасушалардың өсу кезеңінің логарифмдік фазасының соңында. Осы мезгілде жасуша қабықшалары ферменттердің әсерімен оңай ыдырап, өміршең протопластарды береді. Протопластардың тіршілікке икемділігі оларды бөліп алу жағдайлары мен тәсілдеріне байланысты. Жасушаның плазмолиз кезінде сусыздандырылуы және қабығының бұзылуы оны шок күйіне (күйзеліске) душар етеді. Бұл жағдайда цитоплазманың вакуольденуі артады, көптеген липид тамшылары пайда болады, полисомалардың саны азаяды, ядро мен хлоропластар коюланады. Фермент препаратының сапасы протопластардың бөліп алынған санына, мөлшеріне ғана емес, олардың кейбір қасиеттеріне де әсер етеді. Пектиндер мен целлюлозаларды гидролиздейтін саудалық фермент препараттарына қоспа ретінде протеазалар, липазалар, нуклеазалар және басқа ферменттер, фенолдық қосылыстар, тұздар кіреді. Олар плазмалемманың қасиеттерін өзгертуі мүмкін. Осы токсикалық заттардан құтылу үшін және протопластардың шығуын арттыру үшін ферменттерді тазалауға болады. 3. Протопластарды іп vitro түрлі тәсілдермен өсіруге болады. Өсіру тәсілі тәжірибенің мақсатына байланысты. Алдымен протопластарды қоректік ортада шайқап жуып ферменттерден тазартады. Сонан соң олардың 1 мл ортадағы санын есептеп алады. Жасайтын тәжірибеге сәйкес олардың тығыздығын керек көрсеткішке жеткізеді. Ол үшін протопластарды әр түрлі көлемі бар ортаға салады. Мысалы, протопластардың тығыздығын асыру үшін оларды аз көлемді ортаға салады. Ал, керісінше, протопластардың тығыздығын азайту үшін оларды қоректік орта мол құйылған ыдысқа көшіреді. Сөйтіп, протопластардың 1 мл ортадағы санын оқтын-оқтын есептеу арқылы олардың тығыздығын істейтін тәжірибеге сайма-сай келтіреді. Протопластарды сұйық ортада өсіргенде жасушаларды өсірген сияқты олардың тығыздығы жоғары болуы керек. Көбінесе бұл көрсеткіш 1мл 104 - 105 жасуша болады. Егер қоректік орта сұйықталып, протопластар саны бұдан аз болса, онда олар жөнді өсе алмайды. Өте сұйық суспензияда протопластардың ішіндегі тіршілікке қажетті кейбір метаболиттер плазмалемма арқылы ортаға шығып кететін көрінеді. Протопластардың өсуіне жақсы жағдай жасау үшін «қоректік қабат» әдісін пайдаланады немесе байытылған ортаны қолданады, болмаса олар өсіп жатқан ортаның көлемін минимумға дейін азайтады. «Астыңғы қоректік қабат» ретінде рентген немесе гамма-сәулелері әсер еткен протопластар мен жасушалар пайдаланылады. Сол әсерден ондай жасушалар бөліну қабілетінен айырылады, бірақ басқа жасушалардың өсуіне жағдай туғызады. Осы әдістің тағы бір түрі, ол нашар өсетін протопластарды жақсы өсетін протопластармен бірге өсіру. Байытылған орталар өсімдіктердің шамалы түрлері үшін ғана оң әсерін тигізеді. Протопластарды өсірудін кең таралған әдісі, оларды жоғары ылғалдылықта көлемі 20-40 мкл тамшыларда өсіру. Петри табақшасының қақпағында немесе түбіндегі кішкене тамшыларға протопластар автоматтық пипеткамен салынады. Протопластарды өсіру үшін бұл әдістің тиімділігі - материалдар мен уақытты үнемдеп, қоректік ортаның мыңдаған варианттарын тексеруге мүмкіншілік береді. Бірақ бұл әдістін де кемшілігі бар, ол протопластардың тамшының ортасына жайылуы. Протопластарды суспензия ретінде сұйық ортада ғана емес, біраз қоюланған ортада да өсіруге болады. Ол үшін ыдысқа құйылған қоюланған ортаның бетіне жұқа қабат етіп қана протопластарды салады. Бұл әдіс бойынша, сұйық ортамен көлемі тең қоюланған ортада протопластардың концентрациясын екі есе көп етіп өсіруге болады, Протопластарды агары бар қатты ортада да өсіруге болады. Ол үшін протопластар суспензиясын 1,2 % агары баржылы (45°С) көлемі бірдей ортамен араластырады. Орта суып қаткан соң оның ішіндегі протопластар бір-бірінен алыстау болып бекітіліп орналасып қалады. Осы агарда орнықтыру әдісі протопластардың әрқайсысының өсуін жеке бақылап отыруға мүмкіндік береді. Агар орнына агароза қолданылса, жасушалардың бөлінуін арттыруға болады екен. Агароза агардыңқұрамына кіреді, шамасы агар екі полисахаридтің - агароза мен агаропектин - қоспасы. Бұл тәсіл, әсіресе өсу қарқыны бәсең немесе өспей қалған протопластарға қолайлы. Жасуша қабығы қайта пайда болып, жасушаның алғашқы бөлінуіүшін қоректік заттар орташа мөлшерде қажет болады. Ортаның концентрациясы жоғары болса, протопластардың күй-жағдайы тіпті нашарлауы мумкін. Ал екі-үш рет бөлінгеннен сон жасушалар қоректік заттардың жетіспеушілігінің зардабын шеге бастайды. Егер осы кезде орта байытылмаса, бөлінуі тежеліп, клеткалар тіпті кұрып кетуі де мүмкін. Өсіру кезінде қоректік ортаны байытудың екі жолы бар: жоғары концентрациялы қойылтылған ортаны тамшылап қосып отыру және қатты қоректік қабатты қолдану. Протопластарды да жасушалар мен ұлпаларды өсіретін белгілі қоректік орталарда өсіреді. Протопластарды өсіретін қоректік ортаның негізгі айырмашылығы - кальцийдің концентрациясы 2-4 есе артық және 0,4-0,8 М осмостық заттардың қосылуы. Протопластарды өсіру үшін кеңінен қолданылатын қоректік орталар: өзгертілген Мурасиге-Скуг ортасы (көбінесе ол Нагата және Такебе ортасы деп аталады); Гамборгтың В5 ортасы және Као мен Михайлюктін ортасы (бұл витаминдермен, амин қышкылдарымен және қанттармен, кейде фитогормондардың күрделі құрамымен байытылған Гамборгтын В5 ортасы). Бұнда қанттар (ксилоза, рибоза, целлобиоза, манноза, рамноза) осмотик ретінде ғана емес, клетка қабығынын тез пайда болуына да әсер етеді. Протопластарды осіргендегі температура өсімдіктің түріне байланысты 15°С-тан 30°С-қа дейін болады. Әдетте протопластар температураға өте сезімтал. Жарықтың қарқыны 0-ден 2000 люкске дейін болады. 4. Ең бірінші болып 1971 жылы Такебе протопластарды нәтижелі өсіріп, олардан өсімдіктерді шығаруға болатындығын дәлелдеді. Лайықты жағдайда протопластар жасуша қабығын қайта түзіп, кәдімгі нағыз жасушаға айналады. Электрондық микроскоп көрсеткендей, өсімдік протопластарының сыртқы қабатында 10-20 минут өткен сон бірінші целлюлозаның микрофибрильлері пайда болады, ал 20 сағаттан кейін олар қабықтың тығыз торын түзеді. Жасуша қабығының плазмалеммамен байланысының бұзылуы, шамасы, бірден қабықты қайта құру механизмін іске қосады. Ең қызығы, қабығынан айырылмаған плазмолизге ұшыраған протопластың үстінде жаңа қабықтың түзілгені. Қабықтың түзілуінің ерекшеліктері және жылдамдығы бастапқы клетканың түріне және дифференцировкасына байланысты. Алқа, крестгүлділер, шатыршагүлділер тұқымдастар өсімдіктерінің протопластары жасуша қабығын 24 сағат ішінде түзеді. 24-36 сағаттан кейін жасушалар бірінші рет бөлінеді, ал 3-4 апта өткен сон каллус жасушаларының колониясы түзіледі. Өсіру кезінде біртіндеп (2 аптадан кейін) ортаның осмостық қысымын төмендетеді, соның нәтижесіңде бөліну жылдамдығы өседі. Содан кейін каллустарды регенерация өту үшін қатты ортаға көшіреді. Каллуста морфогенездің (органогенез) басталуы, яғни өркен мен тамырлар түзілуі регенерант өсімдіктер пайда болуына әкеледі. Талай өсімдіктердін протопластары сомалық эмбриогенез арқылы да регенерант өсімдіктер түзеді. Оқшауланған протопластардан пайда болған жасушалардың бөлінуге және тотипотенттілігін жүзеге асыруға қабілеттері көптеген факторларға тәуелді: 1) бастапқы ұлпаның түр ерекшелігі, физиологиялық күйі және дифференцировкасы, яғни генетикалық және эпигенетикалық сипаттамасы; 2) протопластарды бөліп алу әдістері мен жағдайлары; 3) протопластарды суспензияда өсіргендегі тығыздығы; 4) қоректік ортаның құрамы; 5) протопластарды өсіру жағдайлары. 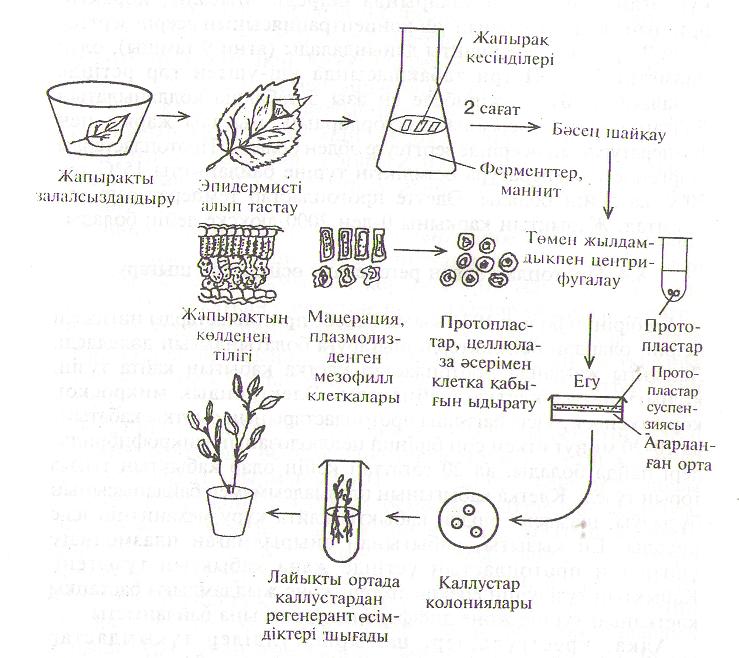 Сурет 2. Картоптың протопластарын бөліп алу, өсіру және регенерацияны өткізу сызбасы Көптеген ауыл шаруашылығына маңызы зор өсімдіктердің жақсы өсетін, ақырында регенерант өсімдік беретін протопластары алынған. Бірақ олардың жасушаларының бөлінуін және дифференциялануын реттейтін факторлар туралы мәліметтер әлі жеткіліксіз. Алқа тұқымдастарына жататын темекінің, шырайгүлдің, картоптың, томаттың протопластарынан регенерант өсімдіктер алу оп-онай, ал астық тұқымдастары мен бұршақ тұқымдастары үшін көпке дейін бұл өте қиын мәселе болып келді. 5. Өсімдіктердің жасушалык инженериясы деген термин кең мағыналы түсінікті қамтиды. Мұның бір мәні - протопластардың бір-бірімен құйылысып қосылуы негізінде жасалатын биотехнологиялық тәсілдер жүйесі. Протопластар құйылысқанда алдымен олар бір-біріне тоғысып жабысады, оны агглютинация деп атайды. Содан кейін олардың мембраналары да қосылып, екі протопластан үлкен бір протопласт пайда болады. Протопластардың құйылысу механизмі түсініксіз, әсіресе мембраналардыңқұйылысуы. Протопластардың өзінен-өзі құйылысуы өте сирек құбылыс, ол екі протопласт арасында плазмодесмалардың кездейсоққалуынан бола алады. Протопластардың сыртында теріс электр заряды болады, сондықтан олар суспензияда бір-бірінен оқшауланады. Құйылысу үшін оларды алдымен бір-бірімен жанастыру керек, сондықтан плазмалемма зарядын өзгерту қажет. Протопластардыңқұйылысуы үшін химиялық және электрлік әдістері пайдаланылады. Химиялық әдіс протопластардың құйылысуына жағдай жасайтын, плазмалемманың электрлік зарядын өзгертетін заттарды суспензияға қосуға негізделген. Э. Кокинг томат тамырының меристемасынан алынған протопластарды қосу үшін нитраттарды пайдаланған. Біраққосылған протопластар аз болған және олар жиі зақымданған. Протопластың сыртында теріс зарядты жою үшін сілтілі ортада (рН=10,5) 50мн СаС12 колданылған. Мезофилдің протопластарын қосу үшін бұл жағдай қолайлы болған, ал каллустық протопластарға жарамаған. Бұдан басқа, протопластарды бір-бірімен жақындату үшін 60 айналымжылдамдықпен 2-3 мин центрифугалаған. Протопластарды жақындатып, тоғыстырудың тағы бір жолы -протопластар суспензиясын капилляр арқылы өткізу. Осындай көп ізденістің арқасында тиімді фюзоген (протопластардын құйылысуына жағдай жасайтын зат) табылды, бұл полиэтиленгликоль болды.  Сурет 3. Протопластардың ПЭГ-тін әсері мен құйылысуының кезеңдері. ПЭГ - суда жақсы еритін полимер, суспензияның осмостық қысымын көтереді. Қосылатын протопластардың суспензиясын алдымен ПЭГ-тың қоюланған (20-30 %) ерітіндісімен өңдегенде протопластар бір-біріне жабысады. 10-15 минуттан кейін Са2+ жоғары мөлшерде (100-300 мМ) бар сілтілі (рН 9-11) ерітіндімен ПЭГ-ты суспензиядан шайып шығарады. Сонан соң протопластарды бір-бірімен жабыстырып тұрған мембраналар құйылыса бастайды. Осындай «ПЭГ - сілтілі рН - мөлшері жоғары Са2+» әдістемесі қазір дүние жүзінде көптеген лабораторияларда қолданылады. Осы әдістемемен 10 %-тен астам (тіпті 50%-ке дейін) протопластарды қосуға болады. ПЭГ қосылғанда протопластар дегидратация арқасыңда бір-біріне жабысады (б). Суспензиядағы суды ПЭГ өзіне сініреді, сондықтан қос қабатты мембраналардың үстіңгісі зақымданып, астыңғы жалаң қабаты басқа мембранамен оңай құйылысады ( в). Мүмкін ПЭГ су ортасының полярлығын төмендетеді,соның нәтижесінде мембрананың полярлық және гидрофобтық компоненттері қайта бөлініп, липидтік құрылымдары тұрақталады. ПЭГ-тің әсерімен мембрана көп жерден тесіледі. Протопластар бір-бірімен жабысқан кезде, сол тесіктер арқылы олардың ішіндегі заттар ары-бері өтеді. Протопластар қосылғаннан кейін де, ең бастапқы кезеңде мембраналардағы тесіктер бітелмейді. Протопластар әбден толығымен қосылған сон ғана олардын мембраналары құйылысып жалпы ортақ бір толық плазмалемма будан протопласты қоршайды. Ақырында протопластар дөнгеленіп будан протопласт пайда болады (г). Бұл әдістін өз кемшіліктері бар, ПЭГ-мен өңдеу нәтижесінде протопластардың көбі зақымданып құриды. Егер екеу емес, одан да көп протопластар қосылса, олар тіршілікке икемсіз келеді. Электрлік құйылысу әдісі биік (20 % және жоғары) жиілігімен өзіне назар аударады. Бұл әдістің негізінде электр өрісі пайдаланады.  Сурет 4. Электр өріс әсерімен протопластардың құйылысуының кезеңдері Протопластар суспензиясы екі электродтың арасында орналасады (а). Айнымалы ток диэлектрофорезді қоздырады, протопластар бір-біріне тақалып бір қатарға тізіледі (б). Бұл тізбектер тек электр өрісі болған кезде туады. Оларға қосымша жеке қатты электр импульсін (600 В/см, 10-20 мкс) бергенде, қатты қысылып тұрған плазмалық мембраналарда тесіктер пайда болады да (в), протопластар бір-біріне құйылып кетеді. Басылып бара жатқан айнымалы электр сигналы цитоплазмалар араласып жатқанда, протопластарды біріктіріп ұстап түрады (г). Электр тогын өшірген соң қосылған протопластар дөнгелектенеді (40). Электр өрісінің әсерінен протопластар бөлме температурасында және рН-тың физиологиялық мөлшерінде нәтижелі косылады. Қысқа қатты импульс мембранаға қысым жасап, протопласт плазмалеммалары қосылып тұрған жерде диэлектрлік бұзылуға себеп болады. Өзгеріліп тұрған электр өрісі мембрана белоктарының латеральдік диффузиясына апарады, соның арқасында белоктары жоқ мембрананың учаскелері пайда болады. Сондай кезде қарама-қарсы тұрған протопластар мембраналары әрекеттесуі мүмкін. Мұнда липид молекулаларымен алмасу, липид көпірлері пайда болуы мүмкін, ақырында мембраналар құйылысады. Электр өрісі көмегімен әр түрлі ұлпалардың және өсімдіктер түрлерінің протопластары қосылады. Жасушалық инженерия әдістеріне протопластарды қосып будандастырудан басқа, клеткалардың жеке бөліктерінен оларды қайта құрастыру да (реконструкция) жатады. Жасушаларға оқшауланған басқа клеткалық органеллаларды (ядро, хлоропластар, митохондриялар) енгізу арқылы генетикалық жүйені қайта құру мүмкіндігі ғалымдардың назарын аударады. Себебі осы әдіспен цитоплазмалық геномда жазылған қасиеттерді бір клеткадан басқа жасушаға ендіріп, құнды өсімдік формаларын шығаруға болады. Мысалы, жоғары активті хлоропластарды енгізуі фотосинтездің қарқындылығын арттырып, өсімдіктің өнімділігін көтереді. Гербицидтерге шыдамдылықты, кейбір ауруларға иммунитетті және токсиндерге реакцияның белгілері хлоропластық ДНК-да жазылады. Ал митохондриялық ДНК-да цитоплазмалық аталық стерильдік белгісі жазылады. Протопластарға сондай белгісі бар митохондрияларды енгізу арқылы өсімдікке осы бағалы қасиетті тән етуге болады. Гаплоидті өсімдіктерді оқшауланған тозаңнан алу екі бағытта: тікелей регенерация және жанама калуссогенез арқылы жүргізілуі мүмкін. Бірінші жағдайда жекелеген тозаңды дәндерден тозаңдар ішінде эмбрионалды құрылымдар қалыптасады, олар егудің белгілі бір жағдайларында гаплоидті өсімдіктерге бастау беретін эмбриоидтарғ дамиды. Эмбриоидтар – ұрық тәрізді құрылымдар. Екіншісінде – тозаң бөлінеді, ал бөлулер нәтижесінде пайда болған жасушалар тез мөлшерде ұлғаяды және тозаң дәнінің қабығын бұзып каллус түзеді. Одан әрі морфогенез нәтижесінде осы каллус жасушаларынан өсімдіктер регенерацияланады. Бұл ретте өсімдіктер әртүрлі плоидты болуы мүмкін – ди-,поли-, анеуплоидия. Оқшауланған микроспора культурасы (ОМК) – ең перспективті әдіс бо– лып табылады. Оқшауланған микроспора культурасы басқа да қолжетімді әдістермен салыстырғанда бірнеше артықшылықтар бар. Эмбриогенді бір гаплоидтық жасушалардың үлкен санын қамтамасыз ете отырып микроспоралар көп мөлшерде бөлінуі мүмкін. ОМК – өз алдына жеке жасушалар болып табылады, бұл бір жасушаны іріктеуді оңтайландырады, микроспораның дамуына ортаның әр түрлі компоненттерінің әсерін тікелей зерттеуге үлкен мүмкіндік береді. Андрогенез әдісі микроспоралар мен піспеген тозаңды дәндердің өз даму жолын гаметофитикалық (жетілгенген тозаңды дәнге апаратын) спорофитика лық деңгейге түрлендіру қабілетіне негізделген екен, бұл жасушалардың гаплоидтық деңгейде бөлінуіне алып келеді, кейіннен каллус немесе эмбриондар пайда бола алады. Андрогенезді асептикалық жағдайларда тозаңды кесуден тұратын техникалық қарапайым әдіс арқылы немесе in vitro жағдайында піспеген тозаң дақылдарының көмегімен индуцирлеуге болады. Тозаңдар қатты, жартылай қатты немесе сұйық ортада немесе екі фазалы жүйелерде (агар - қатайған ортаны жабатын сұйық орта) in vitro инокуляциялайды және өсіреді. |
