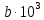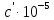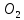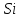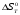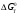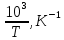ргрка вариант 2-9. Расчетнографическое задание
 Скачать 146.77 Kb. Скачать 146.77 Kb.
|
|
Министерство науки и высшего образования Российской Федерации Федеральное государственное бюджетное образовательное Учреждение высшего профессионального образования «Магнитогорский государственный технический университет им. Г.И. Носова» Кафедра металлургии и химической технологии РАСЧЕТНО-ГРАФИЧЕСКОЕ ЗАДАНИЕ По курсу «Физическая химия» Раздел «Термодинамика» Вариант 2-9 Выполнил: Студент гр (подпись) . Проверил: (подпись) Магнитогорск 2022 1. ФОРМУЛИРОВКА ЗАДАНИЯ 1.1. Исследование 1 Для реакции aA + bB = cC + dD + eE(вариант и номер задания указаны в колонках 1 и 2 табл.1), где A, B, C, D – вещества – участники реакции (колонки 3-7 в табл.1); a, b, c, d, e – стехиометрические коэффициенты реакции выполнить следующее: 1.1.1 Составить уравнение зависимости от температуры величины теплового эффекта Нт = f(T) и изменения энтропии Sт = f(T). 1.1.2 Вычислить величины Cp, Hт , Sт, Gт и lnКр при нескольких температурах, значения которых задаются температурным интервалом и шагом температур (колонки 8 и 9 в табл.1). Полученные значения используются при построении графиков в координатах Cp– Т; Hт – T; Sт – T; Gт – T и lnКр – 1/T. 1.1.3 Пользуясь графиком lnКр – 1/T , вывести приближенное уравнение вида lnКр = А/T + B, где А, В – постоянные. 1.2. Исследование 2 1.2.1. Используя правило фаз Гиббса, для рассматриваемой системы определить количества фаз, независимых компонентов и число степеней свободы. 1.2.2. Определить возможное направление протекания исследуемой реакции и равновесный состав газовой фазы при давлении (кПа) и температуре (К), указанных в колонках 16 и 17, соответственно, табл.1. При решении задачи использовать выведенное в исследовании 1 эмпирическое уравнение lnКр=А/T+B и данные об исходном составе газовой фазы (колонки 11 – 15 в табл.1). 1.2.3. Установить направление смещения состояния равновесия расcматриваемой системы при: а) увеличении давления (постоянная температура); б) увеличении температуры (постоянное давление). Исследование 1. Таблица 1 Исходные данные для термодинамического исследования реакции: 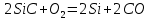
2.1. Расчет изменения изобарной теплоемкости ( 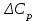 ) и теплового эффекта реакции ( ) и теплового эффекта реакции (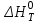 ) )Зависимость теплового эффекта реакции от температуры определяется законом Кирхгофа: 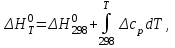 (1) (1) где: 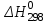 – стандартный тепловой эффект реакции при 298 К; – стандартный тепловой эффект реакции при 298 К;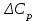 - изменение теплоёмкости системы в результате протекания реакции. - изменение теплоёмкости системы в результате протекания реакции. Последняя величина рассчитывается по уравнению: 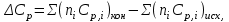 (2) (2)где 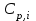 - мольная изобарная теплоёмкость i-го вещества, определяемая из уравнения: - мольная изобарная теплоёмкость i-го вещества, определяемая из уравнения: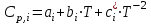 (3) (3)ni– стехиометрический коэффициент i-го вещества в уравнении реакции. Для исследуемой реакции, после подстановки в уравнение (2) ni, оно примет вид: 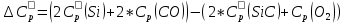 (4) (4)Определим температурные зависимости Сp,i для всех реагентов, используя уравнение (2) и термодинамические данные в табл.1, и занесем данные показатели в таблицу 2: Таблица 2 – Коэффициенты для расчета теплоемкостей веществ по зависимости Cp=f(T)
∆Сp0= 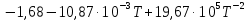 . (6) . (6)Рассчитаем значения 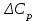 при различных температурах и сведем эти значения в табл.3. При шаге по температуре в 50 К необходимо рассчитать при различных температурах и сведем эти значения в табл.3. При шаге по температуре в 50 К необходимо рассчитать 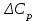 при следующих температурах: 1300,1350,1400,1450,1500, 1550,1600 K. при следующих температурах: 1300,1350,1400,1450,1500, 1550,1600 K.Таблица 3 Зависимость изменения изобарной теплоемкости от температуры для реакции: 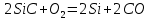
По данным табл. 3 строим зависимость 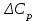 = f(T) , как на рис.1. = f(T) , как на рис.1. Рисунок 1 - Зависимость изменения изобарной теплоемкости от температуры Значение Н298 в уравнении (1) определяется по стандартным энтальпиям образования Н298, i Н298 = (niН298, i)кон - (niН298, i)исх. (7) В рассматриваемом случае уравнение (7) имеет вид: Н298 = (2*Н298(Si)+2Н298(CO))-(2Н298(SiC)+ Н298(O2)) (8) или в числовом виде: 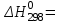 (2*(-110,5))-(2*(-51,9))= -117,2 кДж = -117200 Дж (2*(-110,5))-(2*(-51,9))= -117,2 кДж = -117200 ДжЧтобы в дальнейшем избежать ошибки при расчете 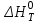 необходимо теплоты образования реагентов в табл.1 из килоджоулей перевести в джоули. необходимо теплоты образования реагентов в табл.1 из килоджоулей перевести в джоули.В соответствии c заданием необходимо рассчитать тепловые эффекты в интервале температур 1350…1600 К. Т.е. для исследуемой реакции), в интервале температур 320…420 К, после подстановки численных значений 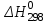 и уравнения (6) в уравнение (1) получим уравнение зависимости теплового эффекта для первой реакции от температуры: и уравнения (6) в уравнение (1) получим уравнение зависимости теплового эффекта для первой реакции от температуры: НT = 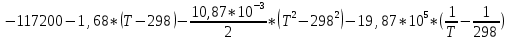 (9) После подстановки значений температур в уравнение (9) получим тепловые эффекты, значения которых сведем в табл. 4. Таблица 4 Величина НТ при различных температурах для реакции:
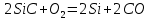 Зависимость 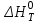 =f(T), построенная по данным табл.3, представлена на рис.2. =f(T), построенная по данным табл.3, представлена на рис.2.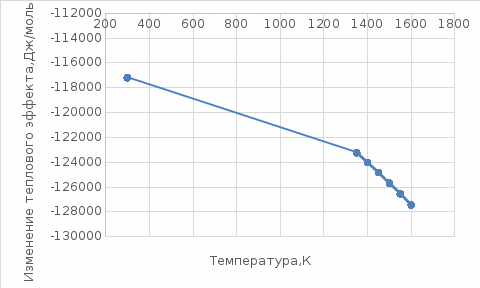 Рисунок 2 - Зависимость теплового эффекта реакции от температуры. 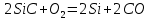 Это прямолинейная зависимость. Из дифференциальной формы закона Кирхгофа (dН)/(dT) = Ср, следует, что тангенс угла наклона касательной, проведённой к кривой при температуре К. Чтобы определить численное значение Ср, возьмём на касательной две произвольные точки “a” и ”b” . Можно записать: tg =Ср(14000C)= 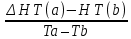 = = 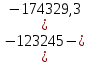 (10) (10)Расчет изменения энтропии реакцииИзменение энтропии системы в результате протекания процесса определяется по уравнению: ∆S⁰т = ∆S⁰₂₉₈ + В этом уравнении 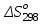 – стандартное изменение энтропии для реакции при 298К, определяемое по мольным стандартным энтропиям веществ – стандартное изменение энтропии для реакции при 298К, определяемое по мольным стандартным энтропиям веществ 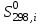 : :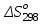 = (ni = (ni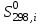 )кон - (ni )кон - (ni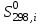 )исх (11) )исх (11)Значения 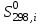 для соответствующих веществ, приведены в табл. 1, после их подстановки в уравнение (11) получим: для соответствующих веществ, приведены в табл. 1, после их подстановки в уравнение (11) получим:S0T= (2*S298(Si)+2S298(CO))-(2S298(SiC)+ S298(O2))=(2*18,72+2*197,4)-(2*16,54+205,08) = 194,08 (Дж/К). По аналогии с выводом уравнения (9) выведем расчетные уравнения зависимости изменения энтропии от температуры для реакции, подставив в уравнение (10) выражение (6). Получим: S0T =194,08+ 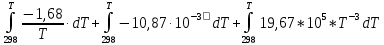 =194,08-1,68*ln(T/298)-(10,87*10-3)/2*(T-298)+19,67*105(1/T2-1/2982) =194,08-1,68*ln(T/298)-(10,87*10-3)/2*(T-298)+19,67*105(1/T2-1/2982)(12) Рассчитаем по этому уравнению изменения энтропии для температур 1350,1400,1450,1500,1550,1600. K а результаты сведем в табл.5. Таблица 5 Величина 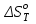 при различных температурах для реакции: при различных температурах для реакции: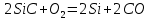
данным табл. 5 построим зависимость 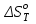 = f(Т) на рис.3. = f(Т) на рис.3.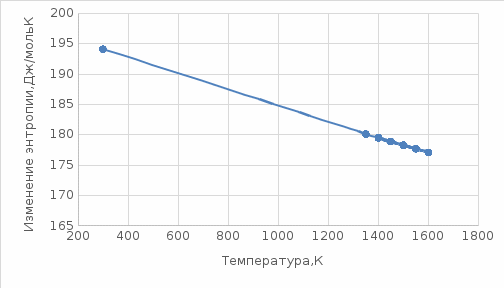 Рисунок 3 - Зависимость изменения энтропии от температуры 2.3. Расчёт изменения стандартной энергии Гиббса При расчете изменения стандартной энергии Гиббса для реакции воспользуемся уравнением Гиббса-Гельмгольца: 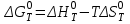 . (13) . (13)Найденные по уравнению (13) величины изменения стандартной энергии Гиббса приведены в табл. 6, по данным которой построена зависимость 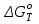 = f(Т), изображенная на рис. 4. = f(Т), изображенная на рис. 4.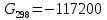 -298*(194,08) = -175035,84 Дж -298*(194,08) = -175035,84 ДжТаблица 6. Значения изменения стандартной энергии Гиббса (GT) при различных температурах
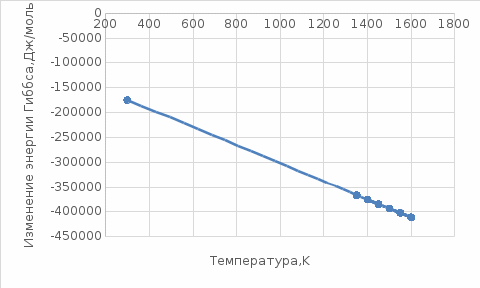 Рисунок 4 - Зависимость изменения стандартной энергии Гиббса от температуры В выбранном интервале температур GT имеет отрицательные значения. Это значит, что при стандартных состояниях веществ (активности всех веществ равны единице) возможное протекание процесса слева – направо. 2.4.Вывод уравнения зависимости константы равновесия от температуры Константа равновесия связана с изменением стандартной энергии Гиббса соотношением: 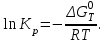 (14) (14)После подстановки выражения (13) в уравнение (14) получим: 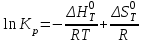 . (15) . (15)Можно полагать, что в сравнительно небольшом интервале температур для исследуемой в данном примере реакции тепловой эффект реакции ( 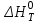 ) и изменение энтропии ( ) и изменение энтропии (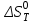 ) практически постоянные величины (это подтверждают и расчеты, приведенные в табл. 4 и 5). Отсюда уравнение (15) можно записать в виде: ) практически постоянные величины (это подтверждают и расчеты, приведенные в табл. 4 и 5). Отсюда уравнение (15) можно записать в виде:lnKp = (A/T) + B, (16) где А и В – постоянные, которые соответственно равны: A = - 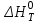 /R, (17) /R, (17)B = 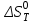 /R . (18) /R . (18)Уравнение (16) отвечает линейной зависимости lnКp = f(1/T). Для построения зависимости lnКp = f(1/T) определим lnKp из уравнения (14) и сведем полученные данные в табл.7. Таблица 7 Величины констант равновесия при различных температурах
Для графического определения констант A и B в уравнении (16) по данным табл.6 строим зависимость lnKз = f(1/Т), приведенной на рис.5. 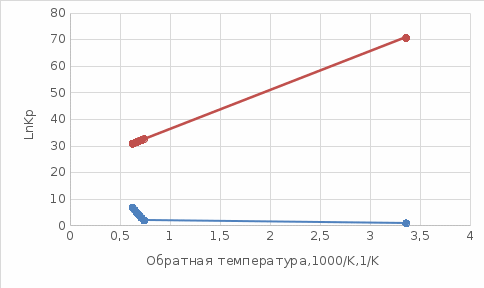 Рисунок 5 - Зависимость lnKp от обратной температуры для реакции: 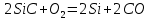 График на рис.5 представляет собой прямую, тангенс угла которой к оси абсцисс численно равен коэффициенту А в уравнении (16). Для нахождения величины тангенса возьмём на прямой, как это показано на рис. 5, произвольно две точки “а”и”b” и определим численные значения их ординат и абсцисс. Можно записать: A= 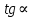 =(lnKp(a)-lnKp(b))/(1/T(a)-1/T(b))=(32,659-(30,897))/((1/1350)-(1/1600))=15223,77 =(lnKp(a)-lnKp(b))/(1/T(a)-1/T(b))=(32,659-(30,897))/((1/1350)-(1/1600))=15223,77Для определения численного значения В поступим следующим образом. Из табл. 6 возьмём значение lnКp при 1000/T=0,740  (lnKp =32,659), подставим его вместе с численным коэффициента А, найденным ранее, в уравнение (16), которое предварительно выразим через В. (lnKp =32,659), подставим его вместе с численным коэффициента А, найденным ранее, в уравнение (16), которое предварительно выразим через В. B = lnKp – A·1/T =0,740-(15223,77*(1/1350)) = -10,536 Итак, приближенное уравнение зависимости константы равновесия от температуры имеет вид: lnKp = 15223,77/T-10,536 (19) Последнее уравнение позволяет рассчитать значение Кp при любой температуре, если последняя находится в заданном интервале (т.е. 1350…….1600 К). По значением коэффициента А и В рассчитаем величину среднего теплового эффекта реакции - 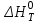 и изменения энтропии - и изменения энтропии -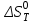 . Согласно уравнениям (17 –18)имеем: . Согласно уравнениям (17 –18)имеем: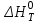 = -A•R= -(15223,77)•8,31 = -126509,53 (Дж); = -A•R= -(15223,77)•8,31 = -126509,53 (Дж);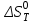 = B•R = -10,536•8,31 = -87,55 (Дж/К) = B•R = -10,536•8,31 = -87,55 (Дж/К)Полученные данные неплохо согласуются с данными, приведенными в табл. 4 и 5, что указывает на правильность расчетов. 3. Исследование 2 3.1. Определение числа фаз, независимых компонентов и степеней свободы Рассматриваемая система состоит из трех фаз: двух твердых фаз SiC и Si, а также одной газообразной, представляющей смесь газов O2 и CO. Итак, ф=3. Число независимых компонентов (k) равно наименьшему числу веществ, необходимых для выражения состава всех фаз системы. Это число определяет как общее число веществ в системе (m) за вычетом число связей между ними (r).Связь между веществами, входящими в рассматриваемую систему, выражается уравнением реакции. Следовательно: k=m-r=4-1=3 Число степеней свободы равно числу параметров системы, которые можно изменить в некоторых пределах так, чтобы число и природа фаз оставались прежними. По правилу фаз Гиббса: С=k+n-ф, где n-число внешних параметров, влияющих на состояние равновесия системы. Обычно это давление и температура, т.е., n=2, Для рассматриваемой системы: С=k+2-ф=3+2-3=2 Если в качестве независимых переменных выбрать давление P и температуру Т, то концентрации O2 и CO в состоянии равновесия будут функциями этих переменных. 3.2. Определение возможного направления реакции Для решения этой задачи воспользуемся уравнением изотермы Вант – Гоффа: 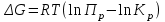 , (22) , (22)где 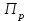 – произведение фактических парциальных давлений газовых компонентов реакции; – произведение фактических парциальных давлений газовых компонентов реакции;Кp – константа равновесия реакции при данной температуре. Напомним, что в соответствии со вторым законом термодинамики в изобарно – изотермических условиях возможно самопроизвольное протекания процессов, сопровождающихся уменьшением энергии Гиббса системы: 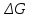 < 0 (23) < 0 (23)В применении к химической реакции это означает, что процесс самопроизвольно может идти слева направо при 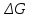 <0 и справа налево при <0 и справа налево при 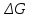 >0. >0.Из уравнения (18) следует, что первое условие ( 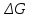 <0) выполняется при <0) выполняется при 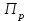 <Кp, а второе ( <Кp, а второе (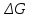 >0) – при >0) – при 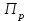 >Кp. >Кp.Таким образом, для ответа на поставленный вопрос необходимо рассчитать константу равновесия при заданной температуре (Т = 1300 К) и величину Пp при содержании, равном O2-50% об. и CO– 50% об., а также общем давлении, равном 101,3 кПа. Найдем величину Кр при 1300 К из выведенного в п. 3.1.4 уравнения (19): lnKp = (15223,77/1300)-10,53 Отсюда: Kp,1300=e1,18=3,228 В соответствии с уравнением реакции 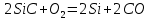 произведение фактических парциальных давлений запишется: 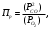 (24) (24)где 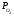 и и 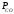 – фактические парциальные давления, соответственно, выраженные в относительных единицах. Для нахождения относительного давления следует давление, выраженное в паскалях, разделить на стандартное давление, равное Pст = 101,300 кПа. – фактические парциальные давления, соответственно, выраженные в относительных единицах. Для нахождения относительного давления следует давление, выраженное в паскалях, разделить на стандартное давление, равное Pст = 101,300 кПа. Определим общее давление, выраженное в относительных единицах: 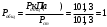 По закону Дальтона парциальное давление компонента газовой смеси равно общему давлению, умноженному на объёмную долю данного компонента: PO2 = 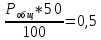 PCO = 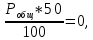 5 5Отсюда произведение фактических парциальных давлений согласно уравнения (24):  Сравнивая Кр и Пр видно, что Кр>Пр, то есть при заданных условиях по уравнению (22) 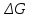 <0 и возможное направление реакции – слева направо, т.е. в сторону образования Si и CO. <0 и возможное направление реакции – слева направо, т.е. в сторону образования Si и CO. 3.3.Определение равновесного состава газовой смеси 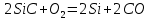 с исходной концентрацией реагентов: Об.% O2 = 50%; Об.% CO= 50%, что соответствует их мольным долям: NO2'= 0,5; NCO= 0,5 при общем давлении: Робщ = 1. Константа равновесия очень мала Для реакции (IV) константа равновесия опишется уравнением 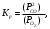 (28) (28)Т.к. константа равновесия велика,Кр =3,228, то очевидно, что реакция, при данных фактических концентрациях реагентов, потечет вправо. При этом концентрация продуктов реакции будет увеличиваться, а исходных веществ – уменьшатся. Таким образом, при равновесии количество молей реагентов будут определяться величинами: n(O2) = 0,5-x ; n(CO) = 0,5+2x. При этом их мольные доли составят: N(O2)= 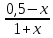 N(CO)= 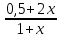 При этом величины их равновесных парциальных давлений составят: PO2 = 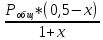 PCO = 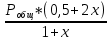 Подставив эти значения в уравнение (28) получим: 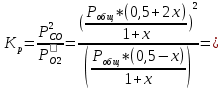 3,228 3,228Левая часть уравнения представляет собой отношение двух конечных чисел, а правое число3,228. Такая ситуация возможна только в случае, если Знаменатель стремится к нулю, т.е. (1+x)→0 или (0,5-x)→0 стремится к нулю Физический смысл имеет корень из второго выражения Приравнивая последние уравнения к нулю и решая их. Получим корень: x=0,5 Равновесные мольные доли реагентов составят: N(O2)= 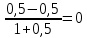 N(CO)= 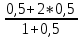 =1 =1Таким образом, равновесная газовая фаза будет состоять в основном из одного реагента: CO, причем его содержание в ней будет: Об.% СO = 100%. 3.4 Установление направления смещения равновесия Качественно направления смещения состояния равновесия определяется принципом ЛеШателье: “если на систему, находящуюся в равновесии, оказывается воздействие, то в системе происходят такое смещение равновесия, которое ослабляет это воздействие”. Исследуемая реакция идет с выделением теплоты ( 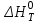 < 0), следовательно, при повышении температуры равновесие должно смещаться cлева – направо. < 0), следовательно, при повышении температуры равновесие должно смещаться cлева – направо. Если протекание реакции сопровождается изменением числа молей газообразных продуктов (Δn ≠ 0), то давление влияет на состояние равновесия. Увеличение давления смещает равновесие в сторону веществ, занимающих меньший объём. В нашем случае, при увеличении давления равновесия сместится влево, а при уменьшении давления равновесие сместится вправо. Библиографический список Краткий справочник физико-химических величин / Под ред. А.А.Равдель и А.М.Пономаревой . л.: Химия, 1983. Краткий справочник физико-химических величин / Под рд. К.П.Мищенко и А.А.Равдель. Л.: Химия, 1974. Справочник химика / Под общ.ред. В.П.Никольского. М.: Химия, 1954 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

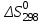
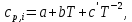 Дж/МольК
Дж/МольК