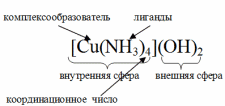
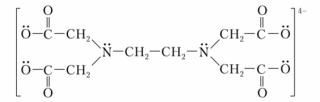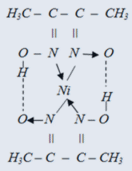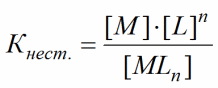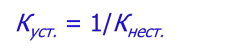тест 3. Равновесия комплексообразования
 Скачать 3.93 Mb. Скачать 3.93 Mb.
|
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Устойчивость комплекса | Катионы металлов | ||||||
| Ag+ | Mg2+ | Ca2+ | Mn2+ | Fe2+ | Ni2+ | Fe3+ | |
| βMY | 2,1∙107 | 4,9∙108 | 5,0∙1010 | 6,2∙1013 | 2,1∙1014 | 4,2∙1018 | 1,3∙1025 |
| lgβMY | 7,32 | 8,69 | 10,70 | 13,79 | 14,33 | 18,62 | 25,1 |
Применение комплексонов в титриметрии
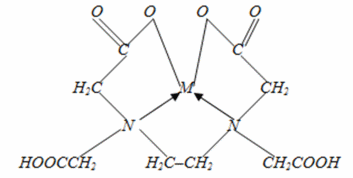
Сама кислота (ЭДТУ) плохо растворяется в воде ( 2 г/л или 7∙10-3 моль/л), поэтому в качестве титранта используют ее динатриевую соль – Na2H2Y (трилон Б).
В общем виде химическую реакцию, положенную в основу комплексонометрического титрования можно представить в следующем виде:
βMY
Мn+ + Н2Y 2- ↔ МY(4-n)- + 2Н+
Определяемый Трилон Б Образующееся
катион комлексное соединение
------------------------------------------------------------------------------------------------------------------------------------------
Кривые титрования: построение и анализ
Построение кривых титрования
Кривая комплексонометрического титрования ионов металла (Мn+) раствором ЭДТУ представляет собой зависимость рМ = f(t), где рМ = -lg [Мn+].
Приведем расчеты для построения кривой на примере титрования 10,00 мл раствора соли Ca2+ с концентрацией 0,1000 моль/л децимолярным раствором Н4У (lgβMY = 10,7).
Рассмотрим расчетные формулы для трех областей:
1. До точки эквивалентности (t < 1):
CM = Cо ∙(1 - t) или
рМ = -lg[Cо∙(1 - t)] = -lgCо – lg(1 - t).
Например, при t = 0,5 рМ = 1 - lg 0,5 » 1,3.
. В точке эквивалентности (t = 1):
Ион металла (М = М2+) присутствует в растворе только за счет диссоциации комплекса МY2- :
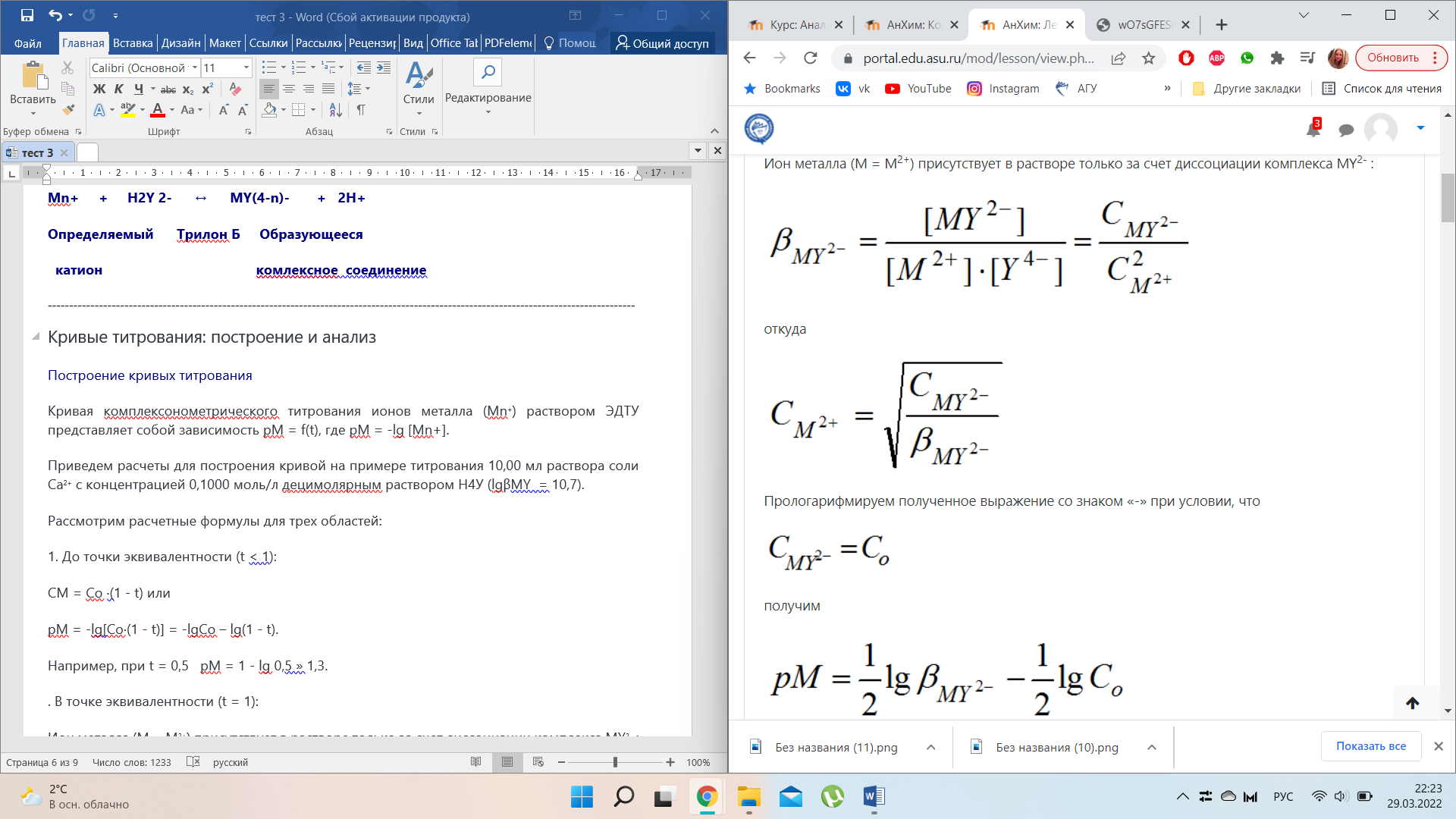
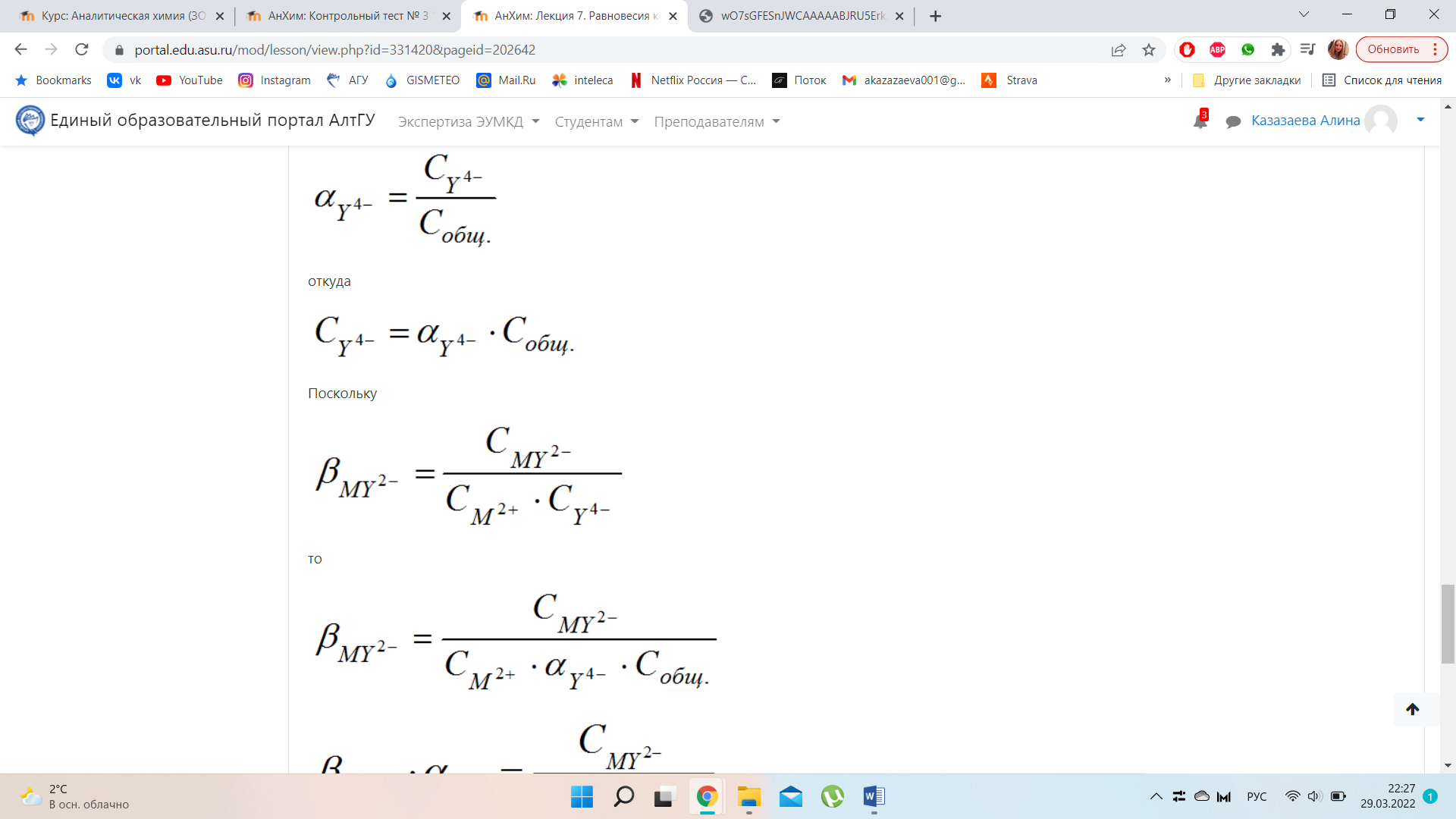
Прологарифмируем полученное выражение со знаком «-» при условии, что
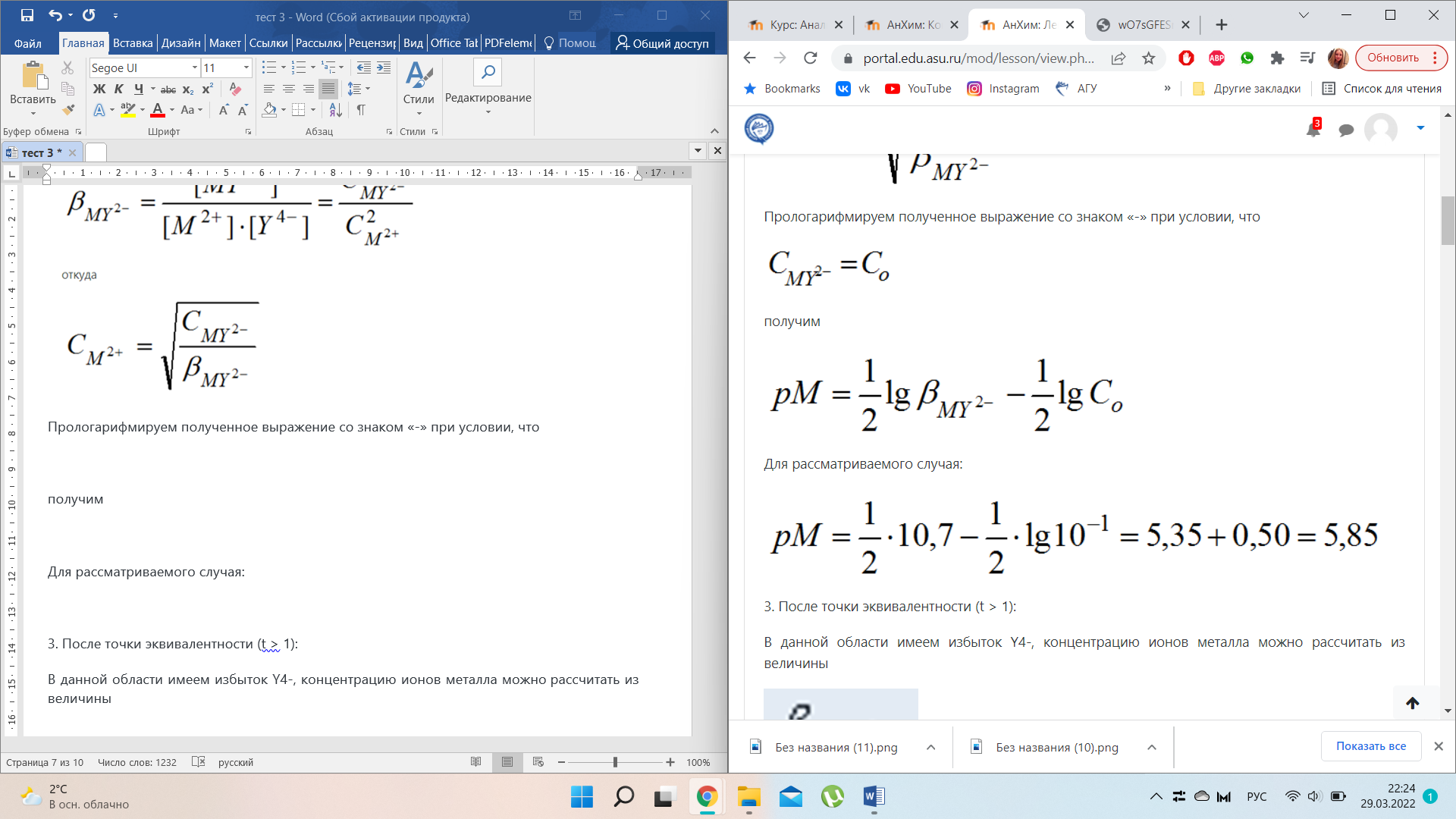
3. После точки эквивалентности (t > 1):
В данной области имеем избыток Y4-, концентрацию ионов металла можно рассчитать из величины
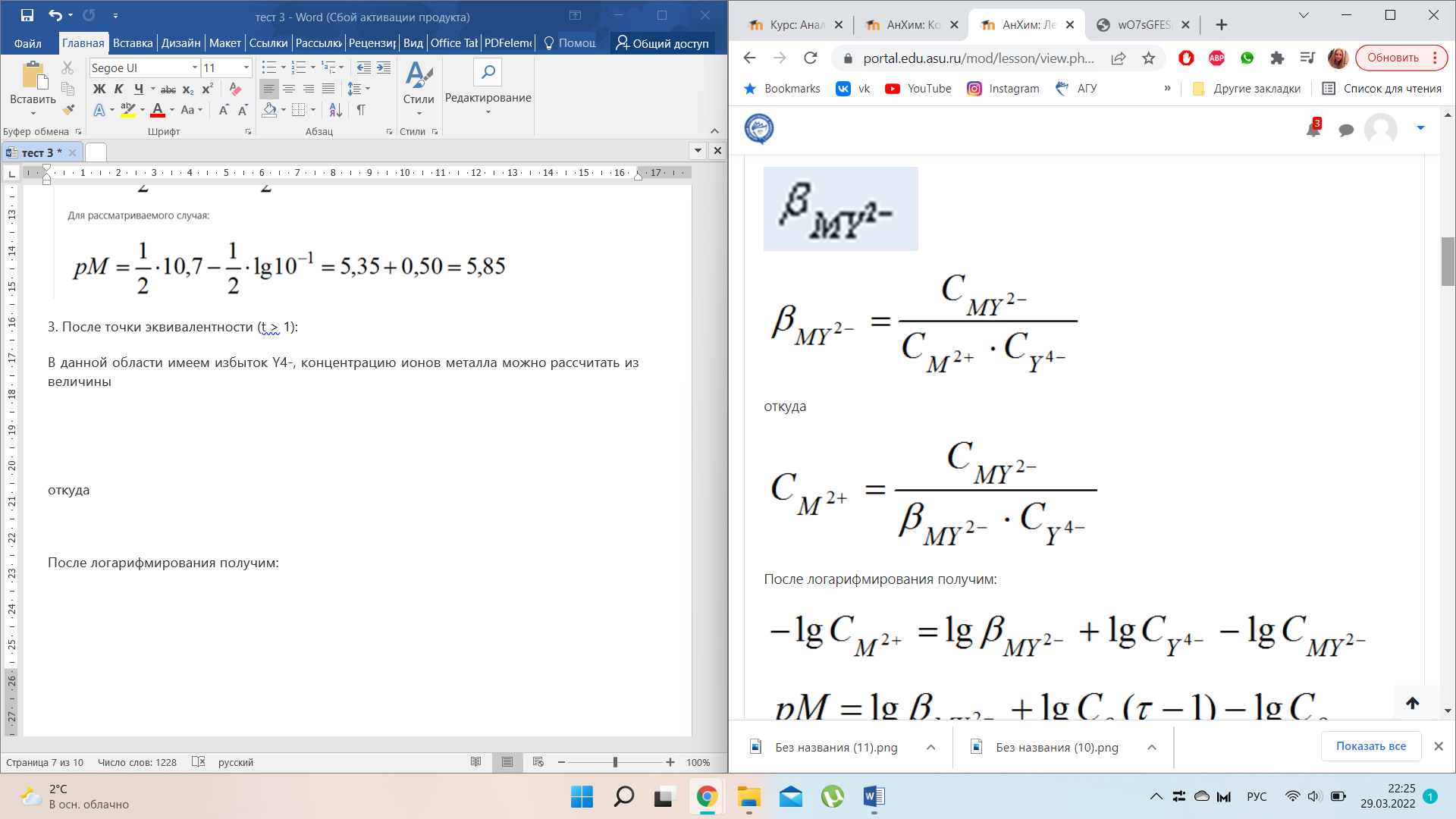
После логарифмирования получим:
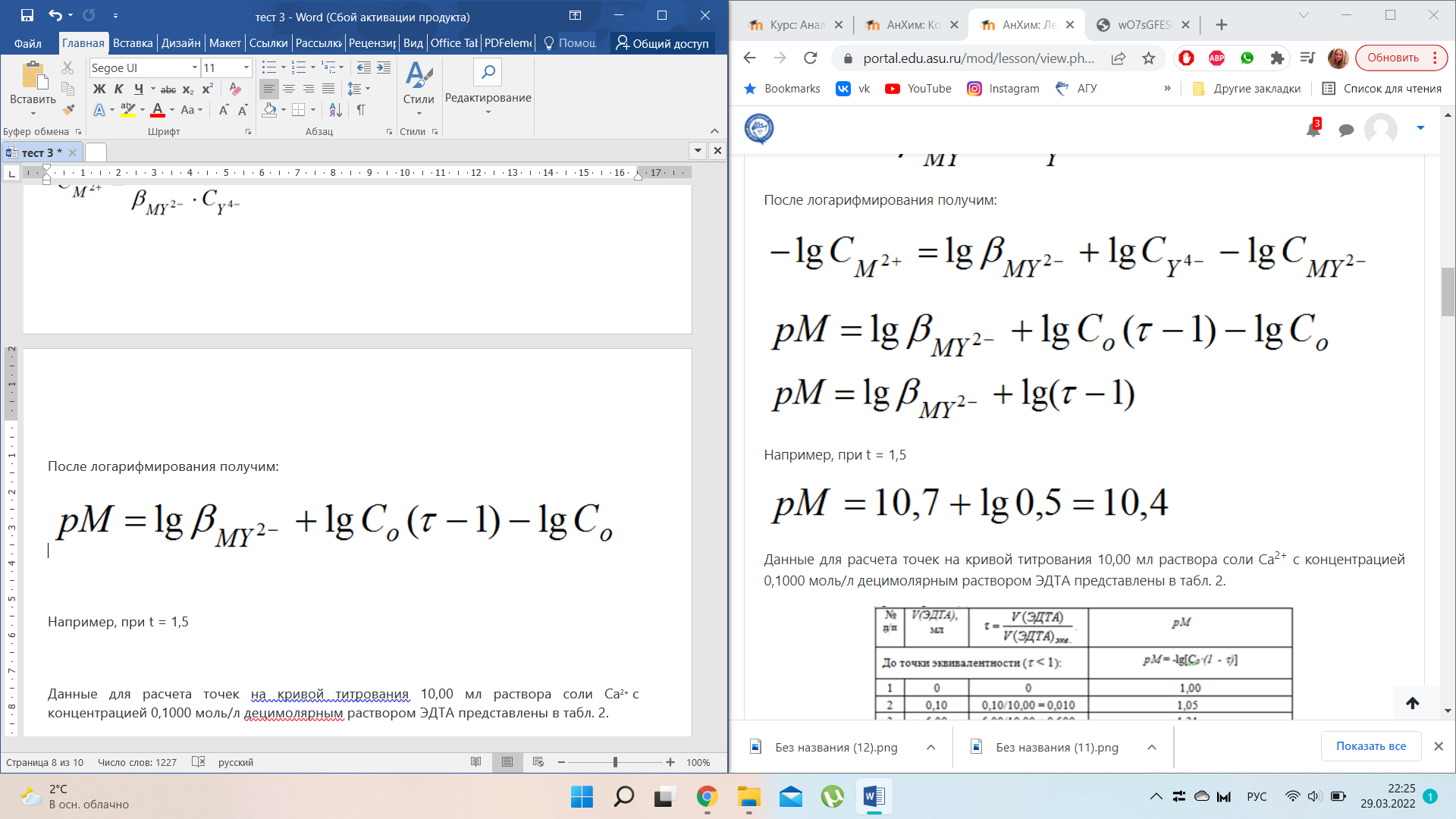
Данные для расчета точек на кривой титрования 10,00 мл раствора соли Ca2+ с концентрацией 0,1000 моль/л децимолярным раствором ЭДТА представлены в табл. 2.
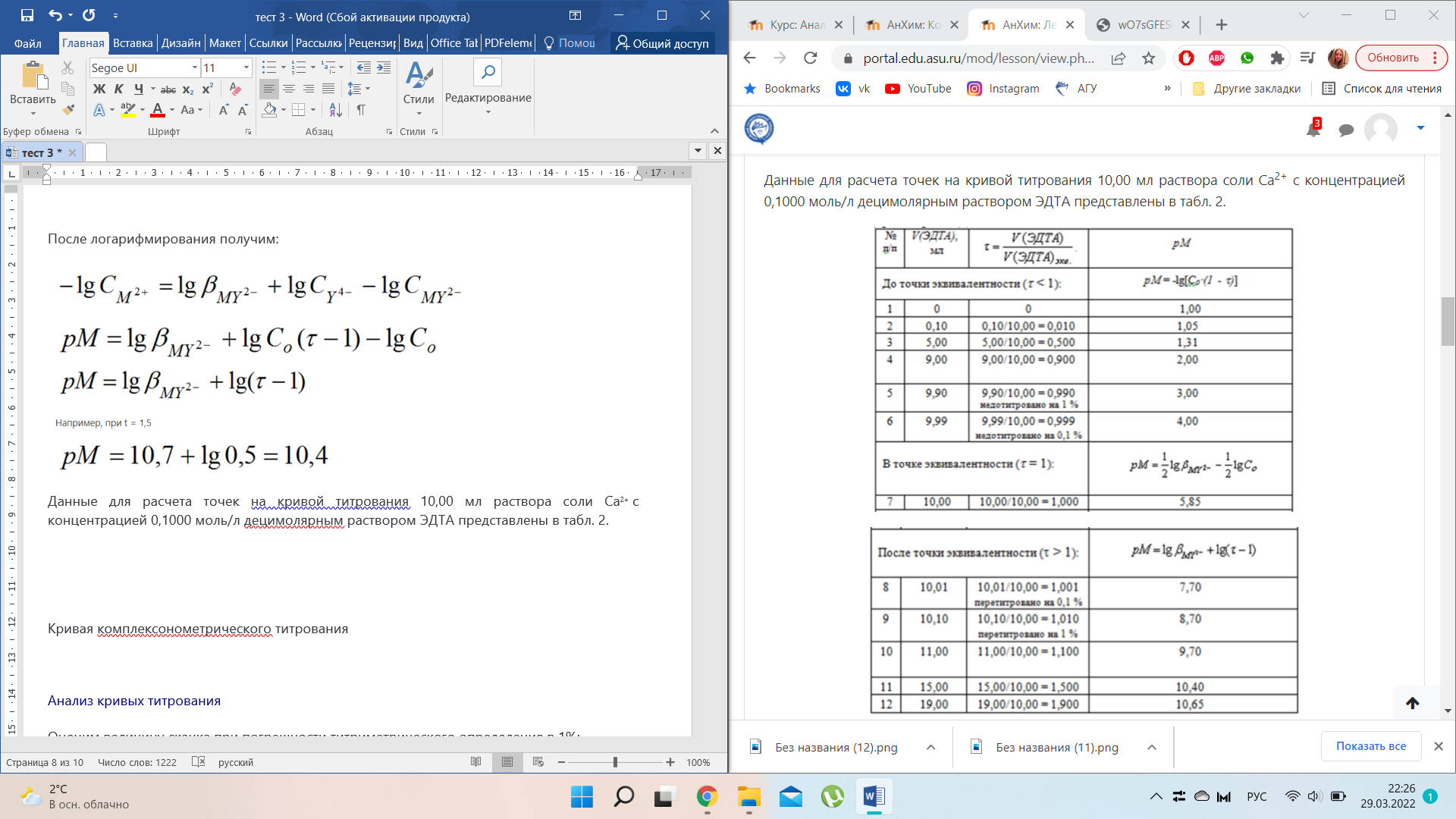
Кривая комплексонометрического титрования
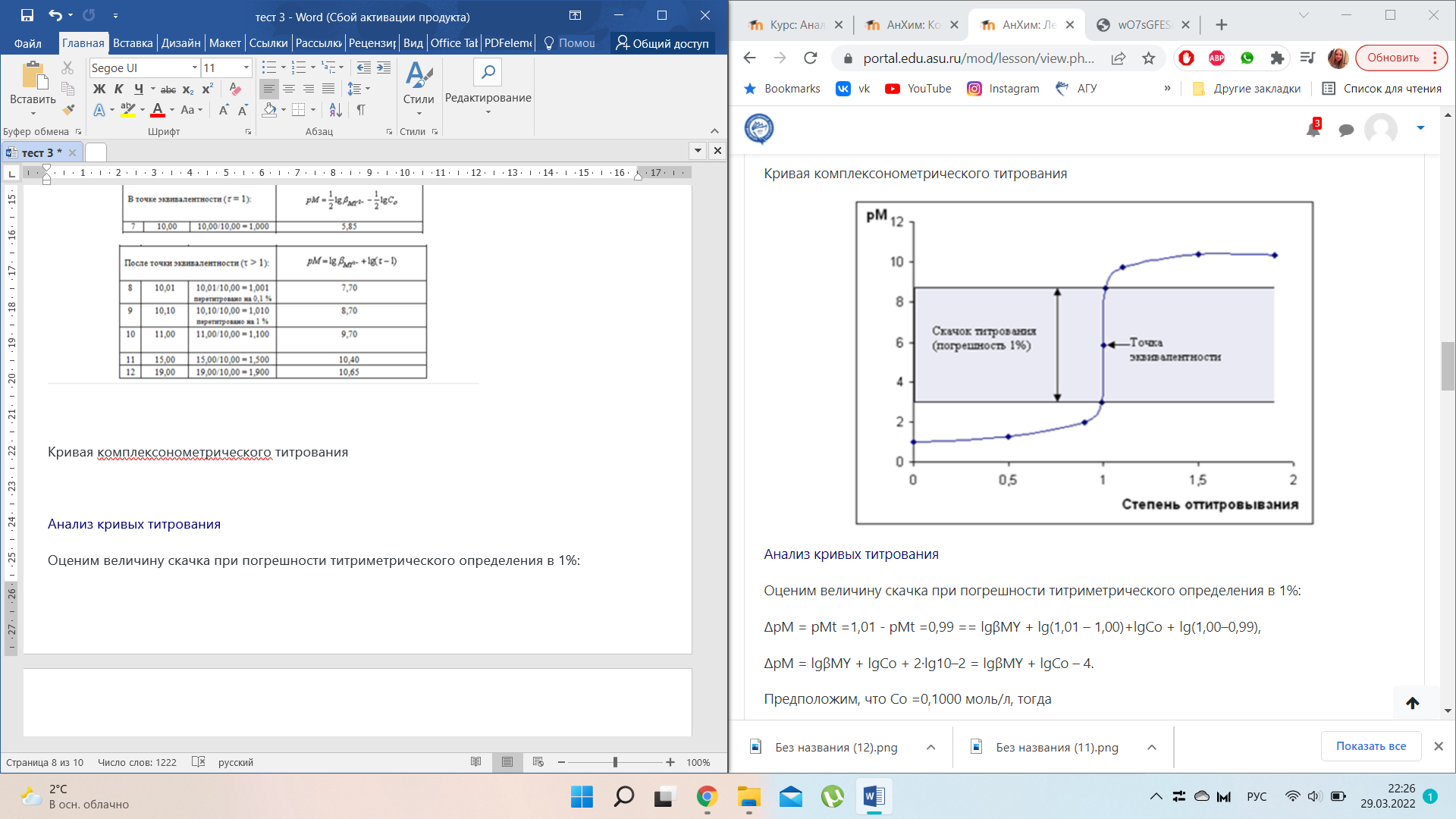
Анализ кривых титрования
Оценим величину скачка при погрешности титриметрического определения в 1%:
ΔрМ = рМt =1,01 - рМt =0,99 == lgβMY + lg(1,01 – 1,00)+lgСо + lg(1,00–0,99),
ΔрМ = lgβMY + lgСо + 2·lg10–2 = lgβMY + lgСо – 4.
Предположим, что Со =0,1000 моль/л, тогда
ΔрМ = lgβMY – 1 – 4 = lgβMY – 5.
Для того чтобы ΔрМ > 0, необходимо, чтобы
lgβMY ≥ 5, то есть раствор соли металла с концентрацией, равной 0,1 моль/л, можно оттитровать с погрешностью 1%, если константа устойчивости его комплекса больше или равна 105.
Оценим величину скачка при погрешности титриметрического определения в 0,1% в тех же условиях:
ΔрМ = рМt =1,001 - рМt =0,999 = = lgβMY + lg(1,001 – 1,000)+lgСо + lg(1,000–0,999),
ΔрМ = lgβMY + lgСо + 2·lg10–3 = lgβMY + lgСо – 6.
При Со =0,1000 моль/л, ΔрМ = lgβMY – 1 – 6 = lgβMY – 7.
Для того чтобы ΔрМ > 0, необходимо, чтобы
lgβMY ≥ 7, то есть раствор соли металла с концентрацией, равной 0,1 моль/л, можно оттитровать с погрешностью 0,1%, если константа устойчивости его комплекса больше или равна 107.
Оценка возможности титрования металлов при заданных значениях рН. С помощью буферных растворов мы можем задавать значения рН и тем самым изменять долю ЭДТА в растворе. Например, в таблице 3 показано как изменяется доля иона Y4-, образующегося из ЭДТА, при различных значениях рН.
| рН | | рН | |
| 1 | 2,1∙10-18 | 7 | 4,0∙10-4 |
| 2 | 3,7∙10-14 | 8 | 5,4∙10-3 |
| 3 | 2,5∙10-11 | 9 | 5,2∙10-2 |
| 4 | 3,6∙10-9 | 10 | 3,5∙10-1 |
| 5 | 3,5∙10-7 | 11 | 8,5∙10-1 |
| 6 | 2,2∙10-5 | 12 | 9,8∙10-1 |
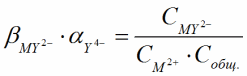
β’– условная константа устойчивости комплекса при определенном значении рН. Условная константа позволяет оценить возможность титрования в заданных условиях.
Пример:
Возможно ли комплексонометрически оттитровать ионы Fe2+ при рН = 3?
Решение: Найдем по табл. 8. долю иона Y4- при рН=3:
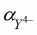 =2,5∙10-11 и по табл. 1 константу устойчивости комплекса ЭДТА с Fe2+: βMY = =2,1∙1014.
=2,5∙10-11 и по табл. 1 константу устойчивости комплекса ЭДТА с Fe2+: βMY = =2,1∙1014.Рассчитаем условную константу устойчивости комплекса при рН = 3:
ß´ =
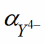 ∙ βMY = 2,5∙10-11 ∙ 2,1∙1014 = 5∙103.
∙ βMY = 2,5∙10-11 ∙ 2,1∙1014 = 5∙103.Ранее было показано, что раствор соли металла можно оттитровать с погрешностью в 1%, если константа устойчивости комплекса больше или равна 105.
Ответ: Поскольку ß´ = 5∙103 < 105, то при рН = 3 комплексонометрическое титрование ионов Fe2+ невозможно.
Индикаторы в комплексонометрии
В качестве индикаторов в комплексонометрии используются органические вещества, способные образовывать комплексные соединения с ионами металлов, причем окраска свободного соединения отличается от окраски комплекса. Поскольку комплексы должны быть окрашены, то в состав органических соединений входят, так называемые, хромофорные группы, например:

поэтому эти индикаторы называются металлохромными.
В результате реакции комплексообразования изменяется электронное строение, что приводит к изменению окраски (при написании уравнения заряды ионов опущены):
β MInd
М + Ind ↔ MInd
окраска 1 окраска 2
Данное равновесие можно охарактеризовать константой устойчивости комплекса ионов металла с индикатором:
Интервал перехода окраски : ΔрМ = lgβMInd ± 1
При использовании металлиндикаторов необходимо выполнение следующего условия: константа устойчивости комплекса иона металла с индикатором должна быть не менее чем в 100 раз меньше, чем константа устойчивости с ЭДТА (титрантом):
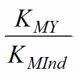
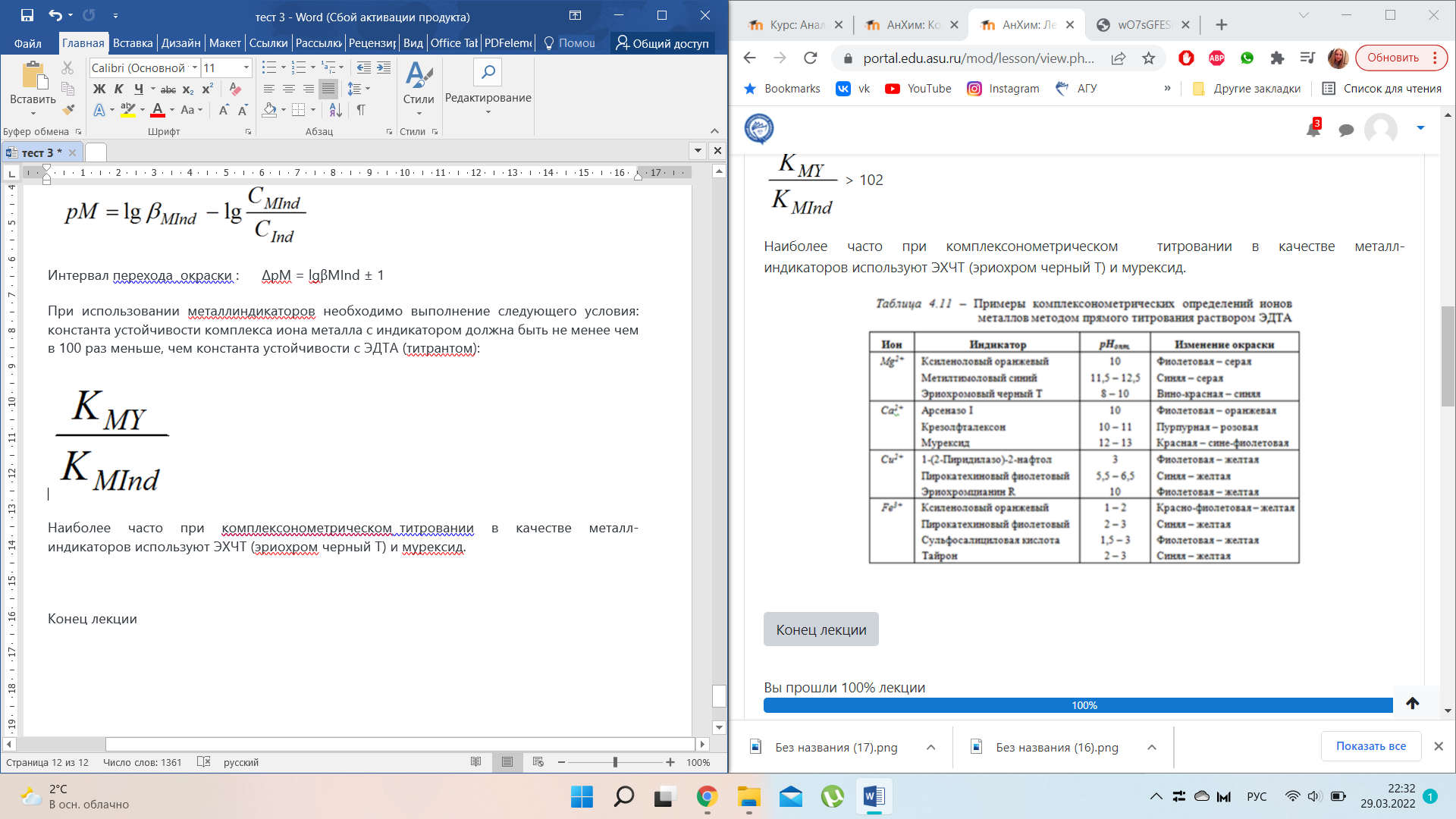
Наиболее часто при комплексонометрическом титровании в качестве металл-индикаторов используют ЭХЧТ (эриохром черный Т) и мурексид.
Начало формы
Конец формы