Кислотно-основное титрование в неводных средах. Кис-основ титрование в неводных ср. Реферат на тему " Кислотноосновное титрование в неводных средах" студентка 3 курса Группы фрм 19. 1
 Скачать 80.37 Kb. Скачать 80.37 Kb.
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ МОСКОВСКОЙ ОБЛАСТИ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ МОСКОВСКОЙ ОБЛАСТИ «ГОСУДАРСТВЕННЫЙ ГУМАНИТАРНО-ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ» Фармацевтический факультет РЕФЕРАТ на тему: “Кислотно-основное титрование в неводных средах” Выполнила: студентка 3 курса Группы ФРМ 19.1 Шулянская А.Д. Проверил: кандида. химических наука Зинин Д.С. Орехово-Зуево.2021г Содержание Введение 2 1. Сущность метода кислотно-основного титрования в неводных средах 3 2. Растворители при неводном титровании 4 3. Критерии выбора растворителя для кислотно-основного титрования 5 4. Применение неводных растворов для кислотно-основного титрования 6 5. Вещества, определяемые в неводных растворах 6 6. Особенности титрования в неводных средах 7 7. Методы титрования в неводных растворах. Стандартные растворы 8 8. Применение в фармацевтическом анализе 8 9. Примеры практических определений в неводных растворах. Титрование анилина в среде неводных растворителей 11 Заключение 13 СПИСОК ЛИТЕРАТУРЫ: 14 ВведениеКоличественный анализ, основанный на измерении объема, называется объемным, или титриметрическим. Титриметрические методы, основанные на кислотно-основных реакциях, включают прямое или косвенное титрование ионов водорода или гидроксила. Кислотно-основные методы широко используются в химическом анализе. Метод кислотно-основного титрования в неводных растворителях применяется для количественного определения веществ, титрование которых в воде затруднено или невозможно из-за их слабовыраженных в этой среде кислотно-основных свойств, малой растворимости, наличия в объектах анализа компонентов или примесей, полностью блокирующих возможность или нарушающих селективность титрования в водной среде. В неводных средах кислотно-основные свойства различных веществ в сравнении с наблюдаемыми в воде могут сильно изменяться, причем эти изменения для различных классов веществ индивидуальны, что позволяет путем адекватного выбора среды обеспечивать не только самую возможность титрования, но и контролировать его селективность. Выбор среды позволяет регулировать кислотно-основные свойства веществ в растворах с целью создания оптимальных условий титрования. 1. Сущность метода кислотно-основного титрования в неводных средахТитрование в неводных средах, или неводное титрование, — такое титрование, при котором средой служит неводный растворитель с минимальным содержанием воды. В качестве неводных растворителей применяют обычно обезвоженные (преимущественно органические) жидкости — индивидуальные вещества или их смеси, например: ацетон, диметилфор - мамид, диметилсульфоксид, диоксан, кислоты (уксусная, муравьиная), уксусный ангидрид, метилэтилкетон, нитрометан, пиридин, спирты (метанол, изопропанол, третичный бутиловый спирт), этилендиамин и другие. Окончание титрования при использовании неводных растворителей фиксируют либо визуальным индикаторным методом, либо, что предпочтительнее, потенциометрически (методом потенциометрического титрования). Метод — фармакопейный, широко используется в количественном анализе многих лекарственных препаратов и включен во все известные Фармакопеи. Применение неводного титрования расширяет возможности титриметрического анализа. Многие органические вещества, не растворимые в воде, хорошо растворяются в различных органических растворителях, что позволяет определять их титриметрическими методами. Силу слабых в водных растворах кислот и оснований можно увеличить подбором растворителя, в котором их титрование становится возможным. Применение растворителей, понижающих силу кислот и оснований по сравнению с их водными растворами, позволяет раздельно титровать такие кислоты, которые являются сильными в водных растворах, например, смесь хлороводородной НСl и хлорной НСlO4 кислот. 2. Растворители при неводном титрованииВ теории неводного титрования большую роль играет влияние растворителя, на кислотно-основные свойства анализируемого вещества. Для неводного титрования применяются различные растворители, которые по своим свойствам делятся на четыре группы. 1. Основные (протофильные) растворители легко присоединяют протоны, усиливают кислотные свойства титруемых веществ. Среди них — диметилформамид НСОN(СН3)2, пиридин, жидкий аммиак и др. В среде основных растворителей легко титруются слабые кислоты, кислые формы .барбитуратов, сульфаниламидов, фенолы. Кислотность этих соединений в среде данных растворителей повышается, и тем самым улучшается процесс и результаты титрования. Титрантом служит раствор гидроксида натрия в смеси метанола и бензола или раствор метилата натрия. В качестве индикатора применяют тимоловый синий. 2. Кислотные (протогенные) растворители: муравьиная кислота НСООН, уксусная кислота СН3СООН (безводная), уксусный ангидрид и др. Они легко отдают протоны, усиливая основные свойства веществ. Титрантом служит раствор хлорной кислоты, а индикатором — раствор кристаллического фиолетового, тропеолина 00 или метилового оранжевого. Растворы титранта и индикатора готовят в безводной уксусной кислоте. Суммарно процесс нейтрализации слабого органического основания хлорной кислотой представлен следующей схемой: R3N + HClO4 → [R2N • H+]ClO4- Подобно происходит титрование производные пиридина (никотинамид, фтивазид), алкалоидов, представляющих собой слабые основания. 3. Амфотерные (амфипротные) растворители: вода Н2О, этанол С2Н5ОН, метанол СН3ОН и др. Эти растворители могут отдавать свои или присоединять протоны от титруемых веществ. В амфипротных растворителях титруют смеси различных кислот. 4. Индифферентные (апротонные) растворители: углеводороды — бензол и его производные, галоген-производные углеводородов (хлороформ, четыреххлористый углерод и др.). Молекулы этих растворителей не способны ни отдавать, ни присоединять протоны. В них титруются смеси оснований. 3. Критерии выбора растворителя для кислотно-основного титрованияПри выборе растворителя для проведения кислотно-основного титрования принимают во внимание следующие критерии. Растворитель, используемый для определения веществ основного характера, должен обладать кислотными свойствами, а для определения веществ кислотного характера – основными. Желательно, чтобы константа автопротолиза растворителя была невелика. Диэлектрическая проницаемость растворителя, по возможности, должна быть большой. Растворитель должен растворять определяемое вещество, по крайней мере, в такой степени, чтобы можно было получить 0,01 М раствор. Растворитель не должен вступать в побочные химические реакции с определяемым веществом. При титровании в данном растворителе должно быть возможно обнаружение конечной точки титрования. Растворитель должен быть не слишком токсичным, легко подвергаться очистке и др. В качестве количественного критерия при выборе растворителя для кислотно-основного титрования можно использовать константу, называемую константой титрования (KT). Данная константа зависит от KSH растворителя и Ka или Kb определяемого вещества. В случае титрования кислот pKT = pKSH - pKa При титровании оснований pKT = pKSH - pKb = pKBH+ Чем меньше величина KТ (больше рКТ), тем более полно идёт реакция титрования, так как образуется более слабое сопряжённое основание в случае титрования кислот или более слабая сопряжённая кислота в случае оснований. Пусть необходимо выбрать растворитель для титриметрического определения слабого основания, например, анилина. Для титрования необходимо взять кислотный растворитель. В муравьиной кислоте анилин будет проявлять более сильные основные свойства, чем в уксусной (pKb равны 0,6 и 5,8 соответственно). Однако, для HCOOH pKT = 6,1 - 0,6 = 5,5, а для CH3COOH pKT = 14,4 - 5,8 = 8,6. Поэтому согласно величине рКТ в качестве растворителя лучше использовать уксусную кислоту. 4. Применение неводных растворов для кислотно-основного титрованияВ настоящее время неводные среды используют в аналитической практике для титрования разнообразных неорганических и органических веществ и для дифференцированного (раздельного) титрования многокомпонентных смесей солей, кислот и оснований. Благодаря этому можно титровать не только сильные кислоты и основания, но и: слабые и очень слабые кислоты и основания; смеси сильных кислот, смеси сильных оснований; смеси сильных и слабых кислот, смеси сильных и слабых оснований; смеси слабых и очень слабых кислот, смеси слабых и очень слабых оснований; смеси сильных, слабых и очень слабых кислот; смеси сильных оснований и солей слабых кислот; смеси сильных кислот и солей слабых оснований; смеси свободных и связанных кислот; соли неорганических и органических кислот; вещества, не содержащие водорода и не являющиеся донорами или акцепторами протонов, но являющиеся (по Льюису) кислотами или основаниями. 5. Вещества, определяемые в неводных растворахБыстрое развитие методов неводного титрования привело к тому, что уже в настоящее время можно количественно определять в неводных растворах гораздо больше веществ, чем в водной среде. Так, в соответствующих неводных средах можно титровать любые кислоты и основания, амины, нитросоединения, фенолы, аминофенолы, аминокислоты, алкалоиды, ангидриды и хлорангидриды, соли органических и неорганических кислот и т.п. В водной среде, вследствие "нивелирующего эффекта" воды, невозможно получить два или несколько изгибов кривой титрования смеси двух или нескольких кислот или оснований до тех пор, пока величины их рК не будут сильно отличаться друг от друга. Например, нельзя в водной среде раздельно оттитровать смеси уксусной и серной кислот, хлористоводородной и муравьиной кислот, серной и молочной. При титровании смесей кислот в среде неводных растворителей наблюдается несколько скачков титрования. Например, при титровании смеси хлористоводородной и муравьиной кислот в среде абсолютного спирта на кривой титрования наблюдается два скачка. В среде ацетонитрила можно дифференцированно (раздельно) оттитровать хлорную и уксусную кислоты; в гликолевой среде раздельно титруются азотная и уксусная кислоты; в пиридине - фенол и уксусная кислота и т. д. В среде неводных растворов могут быть оттитрованы не только индивидуальные сильные, слабые и очень слабые кислоты, но и двух-, трех-, четырех-, пяти-, шести- компонентные смеси, которые не могут быть оттитрованы в водных растворах. 6. Особенности титрования в неводных средах1. Титрование в неводных средах представляет собой очень простой, быстрый и удобный метод количественного анализа многих неорганических, органических и элементорганических соединений. 2. Методы титрования в неводных растворах дают возможность с большой аналитической точностью определять многочисленные вещества, которые при титровании в водной среде не дают резких конечных точек титрования. 3. Одним из важнейших преимуществ методов неводного титрования является то, что они позволяют определять не только растворимые, но и нерастворимые в воде соединения, а также вещества, разлагаемые водой или образующие в водных растворах стойкие нерасслаиваемые эмульсии. 4. Методы титрования в неводных средах могут быть применены для титрования как бесцветных, так и окрашенных растворов. 5. Титрование неводных растворов может проводиться индикаторным, потенциометрическим, кондуктометрическим, амперометрическим и другими физико-химическими методами. 6. При методах неводного титрования во многих случаях не нужно предварительно разделять анализируемые вещества и отделять сопутствующие им примеси или наполнители. 7. Вследствие небольшого, как правило, поверхностного натяжения органических растворителей размеры капель неводных жидкостей меньше размеров капель водных растворов, благодаря чему повышается точность титрования по сравнению с точностью титрования водных растворов. 8. Использование неводных растворителей в аналитической практике дает возможность расширить области их применения в других методах анализа (осаждения, комплексообразования, окисления - восстановления, хроматографии, электрометрических методах) и увеличить ассортимент веществ для приготовления титрованных растворов, пригодных для титрования как мономерных, так и полимерных соединений. 9. Недостатком неводного титрования является необходимость иметь герметизированную титровальную установку. Работа предполагает использование токсичных, летучих растворителей. Однако метод позволяет определять концентрацию солей слабых кислот и слабых оснований, что не всегда возможно в водной среде. Ацетат калия титруется хлорной кислотой по схеме СН3СООК + HClO4 →KClO4 + СН3СООН. 7. Методы титрования в неводных растворах. Стандартные растворыВ качестве стандартного раствора для титрования веществ основного характера применяют 0,1 н. раствор HCIO в безводной уксусной кислоте или диоксане. Такой раствор готовят смешением 8,5 мл 72%-ной НСlO с 900 мл безводной уксусной кислоты и 30 мл уксусного ангидрида или с 1 л диоксана. Установку титра ведут по гидрофталату калия, который растворяют при нагревании в безводной уксусной кислоте. Титрование проводят в присутствии кристаллического фиолетового. Кроме гидрофталата применяют карбонат натрия, растворяющийся в безводной уксусной кислоте с образованием ацетата натрия. В качестве стандартного раствора для титрования веществ кислотного характера применяют 0,1 н. растворы метилата калия или натрия в смеси бензола с метанолом или 0,1 н. спиртовой раствор гидроокиси тетраэтиламмония. 8. Применение в фармацевтическом анализеТитрование в кислотных растворителях. В качестве кислотных растворителей используют уксусную кислоту, уксусный ангидрид, а также их смеси с инертными растворителями - дихлорэтаном, бензолом и др. Данные растворители используют при определении слабых оснований, которые могут быть незаряженными (например, кофеин, амидопирин) или заряженными (анионы). Титрантом обычно является HClO4 (раствор в ледяной уксусной кислоте). Хлорная кислота, в отличие от HCl или H2SO4, остаётся достаточно сильной кислотой и в среде CH3COOH. Стандартный раствор (0,1 моль/л) HClO4 в ледяной уксусной кислоте готовят по следующей методике. Определённый объём 57% или 72%-ного водного раствора HClO4 растворяют в ледяной уксусной кислоте. Затем к полученному раствору для удаления лишней воды прибавляют уксусный ангидрид. После охлаждения раствор доводят ледяной уксусной кислотой до объёма 1 л. Приготовленный раствор должен содержать не менее 0,01% и не более 0,2% воды. Стандартизацию раствора титранта проводят по гидрофталату калия. Обнаружение конечной точки титрования осуществляют потенциометрически либо с помощью трифенилметановых индикаторов: кристаллического фиолетового или метилового фиолетового. Одним из лекарственных веществ, которые определяют методом неводного титрования, является кофеин. В водном растворе кофеин проявляет очень слабые основные свойства, поэтому кислотно-основное титрование в водной среде для его определения использовать невозможно. В среде уксусного ангидрида основные свойства кофеина значительно повышаются (рКВН+ = 6,30) и его титриметрическое определение становится возможным. Точную навеску высушенного до постоянной массы образца кофеина растворяют в смеси уксусного ангидрида и бензола и титруют стандартным раствором HСlO4 (0,1 моль/л) в ледяной уксусной кислоте. 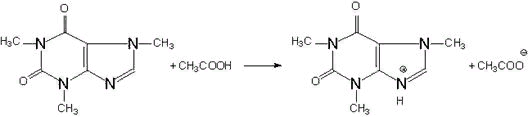 HClO4 + CH3COOH = ClO4- + CH3COOH2+ ион ацилония  CH3COO- + CH3COOH2+ = 2 CH3COOH CH3COO- + CH3COOH2+ = 2 CH3COOHКонечную точку титрования обнаруживают с помощью кристаллического фиолетового. С учётом того, что HClO4 в уксусной кислоте находится, главным образом, в виде ионных пар CH3COOH2+·ClO4- (уксусная кислота – неполярный растворитель), уравнение реакции взаимодействия кофеина с титрантом можно представить и так: Многие из лекарственных веществ представляют собой соли, образованные органическим катионом и неорганическим анионом (галогенидом, сульфатом, нитратом и т.д.). Последний, с точки зрения теории Бренстеда, является основанием и может быть определён ацидиметрически. В водных растворах перечисленные анионы обладают очень слабыми основными свойствами и не могут быть оттитрованы. В уксусной кислоте их основные свойства усиливаются. Сульфаты, нитраты, гидротартраты и некоторые другие анионы можно определять прямым титрованием раствором HClO4. Галогениды определяют способом титрования заместителя. При помощи обменной реакции с ацетатом ртути (II), соединением, практически не диссоциирующим в уксусной кислоте, получают эквивалентное галогениду количество ацетата. Галогениды при этом связываются в комплексный галогенид ртути. Затем выделившиеся ацетат-ионы (а это то же самое, что и ОН- в водном растворе) титруют раствором HClO4. Например, реакции, лежащие в основе титриметрического определения хлорида четвертичного амониевого иона, выглядят следующим образом: 2R4N+·Cl- + Hg(CH3COO)2 ·HgCl2 + 2 R4N+·CH3COO- R4N+·CH3COO- + CH3COOH2+·ClO4- · R4N+·ClO4- + 2CH3COOH Раствор хлорной кислоты можно использовать для определения слабых оснований (в т.ч. и анионов) не только в кислотных, но и в амфотерных и инертных растворителях (метаноле, ацетоне и др.). Для стандартизации титранта в этом случае используют гидрофталат калия, салицилат натрия, дифенилгуанидин. В качестве индикаторов применяют троеполий 00, метиловый оранжевый и другие вещества. Титрование в основных растворителях Из группы основных растворителей в фармацевтическом анализе используют, главным образом, диметилформамид. Это вещество не имеет неприятного запаха, относительно малотоксично, мало гигроскопично, устойчиво к действию CO2. Диметилформамид применяют в качестве растворителя при определении различных лекарственных веществ кислотного характера (барбитураты, сульфаниламиды и др.). В качестве титрантов используют 0,1 М CH3ONa в бензоле, а также 0,1 М NaOH в смеси метанола и бензола и 0,1 М [(C2H5)4N]OH в бензоле. Стандартизацию растворов титрантов проводят по бензойной кислоте. Конечную точку титрования обнаруживают потенциометрически или с помощью сульфофталеинового индикатора тимолового синего. Рассмотрим, например, титриметрическое определение фенобарбитала (в водном растворе рКa1 = 7,21). Точную навеску образца фенобарбитала растворяют в диметилформамиде (предварительно нейтрализованном по тимоловому синему) и титруют 0,1 М NaOH в смеси метанола и бензола. Для обнаружения конечной точки титрования используют тимоловый синий. В аптечной практике для количественного определения теобромина и теофиллина можно применить метод неводного титрования в среде протофильных растворителей (диметилформамид, пиридин и др.) за счет наличия имидной группы.  9. Примеры практических определений в неводных растворах. Титрование анилина в среде неводных растворителейРастворитель титрование кислота анилин Навеску исходного анилина около 0,3 - 0,5 г, взятую на аналитических весах, растворяют в конической колбе в 50 мл безводной уксусной кислоты и титруют 0,1 н. раствором хлорной кислоты. В качестве индикатора применяют 0,2%-ный хлорбензольный раствор кристаллического фиолетового. В точке эквивалентности фиолетовая окраска индикатора меняется на синюю. Конечная точка титрования соответствует началу перехода окраски от синей к сине-зеленой. Конец титрования можно определить также потенциометрически. Титрование анилина в безводной уксусной кислоте хлорной кислотой протекает согласно уравнениям: С6H5NH2 + CН3СООН - С6H5NН3+ +CН3СОО- HClO4 + CН3СООН-CН3СООН2++ ClO4- CН3СООН2+ + CН3СОО –> CН3СООН С6H5NН3+ + ClO4- > С6H5NH2•HClO4 С6H5NH2+ HClO4 > С6H5NH2•HClO4 Для приготовления стандартного раствора в сухую мерную колбу с притертой пробкой наливают 900 мл сухого метанола и помещают колбу в водный термостат (250С). В этот же термостат помещают меньшую колбу, в которую налито 200 мл метанола. Затем отвешивают 15,0 г дистиллированной воды и вливают в первую колбу. Когда содержимое колбы примет температуру термостата, объем жидкости в колбе доводят до метки, добавляя метанол из меньшей колбы. Приготовление титрованного раствора хлорной кислоты в диоксане Для титрования оснований в среде безводной уксусной кислоты иногда применяют 0,1 н. раствор хлорной кислоты в диоксане. При этом конец титрования наблюдается более четко, чем при использовании титрованного раствора хлорной кислоты в среде безводной уксусной кислоты. Конец титрования определяют либо по изменению окраски индикатора, либо потенциометрически. Для приготовления раствора исходной кислоты 8,5 мл 72%-ной хлорной кислоты и 30 мл уксусного ангидрида растворяют в 1 л очищенного диоксана. При наличии более разбавленной хлорной кислоты берут соответственно большие количества кислоты и уксусного ангидрида. Титр устанавливают по гидрофталату калия, растворенному в безводной уксусной кислоте. Для очистки диоксан в течение 1 ч встряхивают с асбестом, а затем фильтруют, перегоняют над металлическим натрием и пропускают через ионообменную колонку, заполненную ионитом в ОН-форме. ЗаключениеОбласть практического применения методов кислотно-основного титрования весьма обширна. Интенсивно развиваются методьі кислотно-основного титрования в неводных средах. Методы титрования в неводных средах имеют ряд преимуществ перед титрованием в водных растворах. Это простой и удобный метод количественного анализа, часто не требующий отделения определяемого вещества от примесей. Методы неводного титрования позволяют определять не только растворимые, но и нерастворимые в воде соединения. Быстрое развитие методов неводного титрования привело к тому, что в настоящее время можно количественно определять в неводных растворах гораздо больше веществ, чем в водной среде. СПИСОК ЛИТЕРАТУРЫ:1. Алексеев В.Н. Количественный анализ. - М.: Химия, 1972. - 323 с. 2. Васильев В.П. Аналитическая химия. - М.: Высшая школа, 2007. - Ч. 1, 162 с. 3. Государственная фармакопея Российской Федерации XIV издания 4. Учебное пособие по фармацевтической химии Г.А. Меленьтьева, М.А. Краснова. 5. https://pandia.ru/text/82/396/21983.php 6.https://do.vsmu.by/mod/page/view.php?id=2772 7. https://studopedia.su/12_114056_kolichestvennoe-opredelenie.html
|
